Các chuyên gia đầu ngành ung thư tại Việt Nam và Úc đã thảo luận về những tiềm năng và thách thức hiện tại của giải trình tự gen thế hệ mới (NGS) giúp khảo sát toàn diện các chỉ dấu phân tử khối u (CGP – Comprehensive Genomic Profiling) trong xét nghiệm gen hỗ trợ điều trị nhắm trúng đích, điều trị miễn dịch và đánh giá động năng ctDNA trong theo dõi đáp ứng điều trị ung thư.
TỔNG QUAN
Giải trình tự gen thế hệ mới – Next Generation-Sequencing (NGS) là một công cụ mạnh mẽ được sử dụng trong giải trình tự bộ gen. Những tiến bộ gần đây trên thế giới đã chỉ ra rằng giải trình tự nhanh hơn, chính xác hơn, giảm chi phí và phân tích đồng thời nhiều gen hơn. Những tiến bộ này mở ra nhiều hứa hẹn tiềm năng và ứng dụng – giúp chúng ta hiểu hơn về bộ gen trong nhiều lĩnh vực khác nhau, trong đó nổi bật nhất là lĩnh vực chẩn đoán và điều trị ung thư.
Tại Hội thảo Chuyên Gia – Advisory Board được tổ chức bởi Gene Solutions phối hợp với Bệnh viện K, các chuyên gia đầu ngành trong lĩnh vực ung thư đã có những trao đổi, thảo luận về ứng dụng công nghệ NGS trên thế giới cũng như tại Việt Nam. Qua 5 bài báo cáo, chúng ta đã thấy được bức tranh toàn cảnh về công nghệ NGS, cho thấy tiềm năng, thực tiễn áp dụng và rào cản của công nghệ mới này trong hỗ trợ điều trị, theo dõi đáp ứng ung thư trên lâm sàng ra sao.
THÀNH PHẦN CHỦ TOẠ VÀ BÁO CÁO VIÊN THAM GIA HỘI THẢO
Chủ toạ:

Báo cáo viên:

BÀI BÁO CÁO CỦA GS. NICK PAVLAKIS
XÉT NGHIỆM CÁC CHỈ DẤU SINH HỌC PHÂN TỬ TOÀN DIỆN (CGP): TỔNG QUAN VÀ ỨNG DỤNG LÂM SÀNG
Bài báo cáo của GS. Nick Pavlakis cho thấy trong lĩnh vực khảo sát hệ gen (genomic), lĩnh vực giải trình tự bộ gen đã có những bước phát triển vượt bậc trong thời gian ngắn. Bắt đầu từ nền tảng giải trình tự Sanger ra đời vào những năm 1970, đến nay chúng ta có giải trình tự thế hệ 2, thường được gọi là giải trình tự thế hệ mới (NGS).
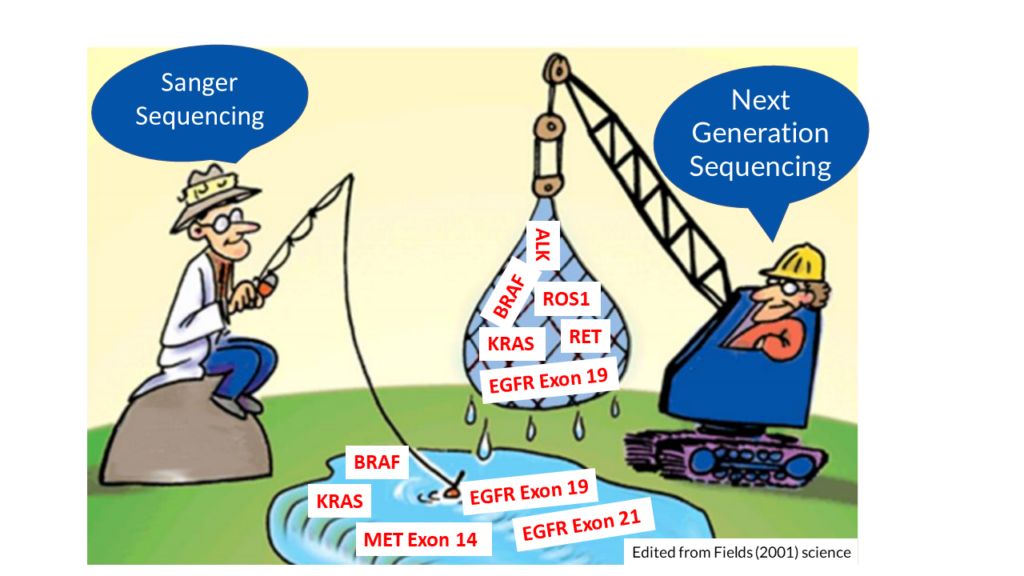
Để dễ hình dung, GS. Nick Pavlakis đã minh họa bằng một hình ảnh so sánh cho thấy sự khác biệt giữa 2 phương pháp này, “Hãy tưởng tượng việc giải trình tự gen giống như câu cá. Mỗi chỉ dấu sinh học (biomarker) được ví như một con cá trong ao. Giải trình tự Sanger giống như việc bạn sử dụng cần câu – Mồi câu được thiết kế đặc hiệu cho từng loài cá nhất định và bạn chỉ có thể bắt được một con cá mỗi lần. Ngược lại, NGS giống như việc bạn quăng lưới, có thể bắt được nhiều loài cá khác nhau cùng một lúc và sau đó phân loại chúng theo loài. Do đó, có thể nói NGS là phương pháp cung cấp thông tin hiệu quả hơn nhiều so với công nghệ Sanger truyền thống”. GS. Nick Pavlakis nhận định thêm rằng “Kỹ thuật giải trình tự gen thế hệ mới (NGS) nhận diện những thay đổi có ý nghĩa trên lâm sàng mà giải trình tự từng phần có thể bỏ sót. Giải trình trình tự gen toàn diện (CGP) cung cấp khả năng lựa chọn các gen sinh ung – oncogene với phạm vi khảo sát (panel gen) rộng hơn. Do đó, CGP lý tưởng cho việc sàng lọc bệnh nhân, giúp tìm ra những đối tượng phù hợp có thể tiếp cận được với các thuốc điều trị mới trong lâm sàng.”
Trong phần trình bày của mình, GS. Nick Pavlakis cũng chia sẻ với các chuyên gia về dữ liệu từ nghiên cứu Aspiration mà ông là đồng chủ trì (co-chair), nghiên cứu đã được công bố tại hội thảo chuyên đề ở Sydney. Nghiên cứu Aspiration là một nghiên cứu đa trung tâm, tiền cứu, quan sát và can thiệp theo nhóm, được tiến hành trên toàn nước Úc. Nghiên cứu này đánh giá việc áp dụng Giải trình tự gen toàn diện (CGP) ngay từ đầu cho tất cả các bệnh nhân ung thư phổi không tế bào nhỏ (NSCLC) giai đoạn di căn so với các phương pháp giải trình tự tiêu chuẩn khác (Standard of Care – SoC). Mục tiêu chính của nghiên cứu là xác định xem CGP có giúp phát hiện thêm các đột biến ở bệnh nhân này hay không. Ngoài ra, nghiên cứu còn đánh giá các đặc tính về hiệu suất của CGP, bao gồm thời gian trả kết quả… và các thông số lâm sàng quan trọng khác. Nghiên cứu đưa ra kết quả trong số 1.000 bệnh nhân tham gia, có 82% đã thực hiện xét nghiệm CGP và trong số đó 50% bệnh nhân được đề xuất liệu pháp nhắm trúng đích. Đáng lưu ý là với giải pháp CGP, số bệnh nhân có kết quả đột biến tăng 42% so với các phương pháp tiêu chuẩn và có 16% bệnh nhân được thay đổi quyết định điều trị nhờ CGP. Tuy nhiên giải pháp CGP cũng cho thấy thất bại ở khoảng 17% bệnh nhân do không đủ mẫu mô, không ly trích đủ DNA hoặc giải trình tự không thành công.
Nghiên cứu cũng cho thấy một số thách thức trong việc thay đổi quy trình chẩn đoán thường quy. Quan trọng nhất là phải đảm bảo lấy đủ mẫu mô bệnh phẩm khi sinh thiết cho bệnh nhân (Ví dụ: ung thư phổi), cần thay đổi mô hình chẩn đoán cho nhiều kiểu mẫu mô hơn như là thông qua Sinh thiết lõi (core biopsy) hoặc Nội soi phế quản/Chọc hút kim nhỏ trên nền siêu âm (EBUS/FNA). Sự chậm trễ trong quá trình vận chuyển mẫu bệnh phẩm chắc chắn ảnh hưởng đến thời gian trả kết quả. Do đó, việc tổ chức các Hội đồng phân tử khối u (Molecular tumor board – MTB) hiệu quả ở khắp các bang là rất cần thiết. Mục tiêu của nghiên cứu Aspiration là cung cấp kết quả CGP trong vòng chưa đến 3 tuần. Tuy nhiên, vẫn cần phải có thêm các thử nghiệm lâm sàng để cung cấp cơ hội tiếp cận các liệu pháp điều trị mới cho bệnh nhân sau khi xác định được các đột biến phân tử có liên quan.
Bên cạnh những thách thức, GS. Nick Pavlakis cũng chỉ ra những tiềm năng từ nghiên cứu mang lại:
- Xây dựng cơ sở bằng chứng: Bên cạnh các dữ liệu sử dụng có giá trị kinh tế, chúng tôi hy vọng nghiên cứu sẽ cung cấp thêm bằng chứng khoa học thuyết phục chính phủ Úc tài trợ cho việc áp dụng Giải trình tự gen toàn diện (CGP) trên toàn quốc.
- Tạo cơ sở dữ liệu phong phú: Nghiên cứu sẽ xây dựng một cơ sở dữ liệu toàn diện, cung cấp thông tin về quá trình hình thành các phân nhóm đột biến hiếm gặp, giúp hiểu rõ hơn về hiệu quả điều trị trên từng phân nhóm cụ thể và tác động của vấn đề xuất hiện đồng đột biến (co-mutation) và các nguồn lực hỗ trợ cần thiết để thực thi hiệu quả.
- Bên cạnh nghiên cứu Aspiration, GS.Nick Pavlakis cũng chia sẻ nhiều nghiên cứu khác nhằm chứng minh lợi ích của kỹ thuật NGS và CGP trên lâm sàng. Ví dụ 1 nghiên cứu ở Canada cho kết quả khả quan khi tích hợp xét nghiệm Giải trình tự gen toàn diện (CGP) vào hệ thống y tế công cộng. Nghiên cứu đã phân tích 182 bệnh nhân và thành công trong 74% các trường hợp với mục tiêu chính là xác định các đột biến đích (actionable mutations).
GS. Nick Pavlakis kết luận phần trình bày của mình: “Ung thư phổi không tế bào nhỏ (NSCLC) là một trong những ung thư có gánh nặng khối u cao nhất trên toàn thế giới và là nguyên nhân hàng đầu gây tử vong do ung thư. Đây là ví dụ điển hình về thành công của liệu pháp nhắm trúng đích với sự phát triển liên tục của các thuốc mới và vai trò thiết yếu của xét nghiệm CGP. Tôi hy vọng đã phần nào cho các bạn thấy xét nghiệm CGP có độ nhạy và độ bao phủ cao hơn các panel NGS giới hạn, giúp xác định nhiều đột biến đích vượt qua các tiêu chuẩn điều trị hiện tại. CGP còn cung cấp thông tin về các đồng đột biến (co-mutation) mang ý nghĩa tiên lượng và tiềm năng điều trị.
Dữ liệu ngày càng nhiều chứng minh CGP có khả năng thay đổi quyết định điều trị và cải thiện tỷ lệ sống còn cho bệnh nhân ung thư. Ngoài ra càng sử dụng rộng rãi, CGP sẽ càng tiết kiệm chi phí. Dữ liệu từ Canada cho thấy bệnh nhân sẵn sàng chi trả thêm hàng trăm đô la để thực hiện CGP bên cạnh các xét nghiệm được bảo hiểm hỗ trợ.
Về tương lai, tôi tin rằng việc sử dụng ctDNA (circulating tumor DNA) kết hợp với phân tích mẫu mô khối u sẽ trở nên phổ biến hơn. Cả 2 phương pháp này đều đóng vai trò quan trọng trong chiến lược quản lý và điều trị bệnh nhân ung thư.”
BÀI BÁO CÁO CỦA TS. BS NGUYỄN DUY SINH
ỨNG DỤNG GIẢI TRÌNH TỰ GEN THẾ HỆ MỚI (NGS) ĐỂ KHẢO SÁT TOÀN DIỆN CÁC CHỈ DẤU PHÂN TỬ KHỐI U
Bài báo cáo của TS. BS Nguyễn Duy Sinh tập trung vào kỹ thuật giải trình tự gen thế hệ mới (NGS) để khảo sát toàn diện các chỉ dấu phân tử khối u (CGP). Ở phần bác sĩ giới thiệu về các chỉ dấu phân tử quan trọng nhất của khối u “Comprehensive Genomic Profiling (CGP)” sẽ tập trung vào những đột biến dẫn đường (driver mutation), bên cạnh những đột biến về thay đổi base pair (thay đổi đơn nucleotit), hay là kiểu Indel mà chúng ta hay tiếp cận theo cách cũ, chúng ta thấy có những thực thể đột biến mới ví dụ như tái sắp xếp (rearrangements) tức là fusion của gen, hoặc là copy number variation (thay đổi số lượng bản sao), tức là khuếch đại gen (amplification).
Gần đây chúng ta nghe nói đến một thực thể kiểu mới gọi là chữ ký đột biến. Chữ ký khối u khác với driver như sau: Thường chúng ta nhìn đột biến ở dưới góc nhìn là hậu quả trên tế bào khối u. Nhưng nếu nhìn ở góc độ nguyên nhân thì chúng ta thấy có mối tương quan giữa nguyên nhân và hậu quả. Ví dụ những hậu quả như MSI thì hay gặp trong ung thư đường tiêu hóa, ngược lại TMB và PD-L1 hay gặp trong ung thư phổi hoặc là Melanoma.
Ngày nay chúng ta ước lượng là có khoảng 20 chữ ký đặc trưng trong ung thư. Như vậy khi khảo sát đột biến somatic, thì chúng ta phải chỉ rõ hết tất cả những thực thể này. Ngoài ra một số những đột biến liên quan đến đột biến dòng mầm nếu phát hiện được thì cách chúng ta xử trí và tiên lượng bệnh nhân sẽ khác.
Như vậy dựa trên dữ liệu CGP, bên cạnh việc chọn lựa điều trị đúng, chúng ta cần phải tiên lượng là bệnh nhân có đáp ứng hay không? Đáp ứng trong vòng bao lâu? Và bao lâu thì hết đáp ứng? Và thậm chí là chúng ta phải nghĩ đến khả năng tư vấn di truyền cho người nhà bệnh nhân nếu bệnh nhân có đột biến dòng mầm.
Với bức tranh toàn cảnh hiện nay và kỷ nguyên điều trị chính xác ung thư (precision oncology) chúng ta cần quan tâm rất nhiều yếu tố như bệnh nhân nào có lợi với điều trị nhắm trúng đích? Bệnh nhân nào có lợi với điều trị miễn dịch? Bệnh nhân nào thì chúng ta kết hợp cả 2 và khi điều trị như vậy thực sự là có tiên lượng tốt hay có đáp ứng tốt hay không? Bao giờ thì bệnh nhân tái phát di căn? Tiên lượng sống còn như thế nào? Để giúp giải quyết những câu hỏi như vậy thì xét nghiệm CGP có nhiều khả năng trả lời được đầy đủ tất cả những câu hỏi này.”
Khi mà những xét nghiệm CGP trên thế giới đang khảo sát toàn bộ những vùng gen mã hóa protein (Whole Exome Sequencing) thì ước lượng là chúng ta phải khảo sát khoảng 38 Mb tương ứng khoảng 22.000 – 27.000 gen và đây là một con số rất lớn. Thực tế trên lâm sàng với chi phí này thì không thể áp dụng được cho bệnh nhân, đặc biệt là ở những nước đang phát triển như Việt Nam. Dựa trên nhu cầu thiết thực đó, TS. BS Nguyễn Duy Sinh giới thiệu tới các chuyên gia về 01 giải pháp được phát triển bởi Gene Solutions “Xét nghiệm khảo sát toàn diện các chỉ dấu phân tử của khối u – K-4CARE” khảo sát 473 gen với chiều dài khoảng 1.5 – 1.7Mb, từ sự tối ưu hóa này K-4CARE mang đến một giải pháp toàn diện với chi phí hợp lý với bệnh nhân hơn, giúp nhiều bệnh nhân có thể tiếp cận công nghệ CGP. Với panel rộng K-4CARE trả được kết quả cho hầu hết ung thư mô đặc với 4 chỉ dấu quan trọng:
- Chỉ dấu miễn dịch (TMB, MSI, PD-L1
- Đột biến đích (actionable mutation) và đột biến kháng thuốc
- Đột biến di truyền
- Theo dõi tồn dư tối thiểu (MRD) và động năng ctDNA của khối u
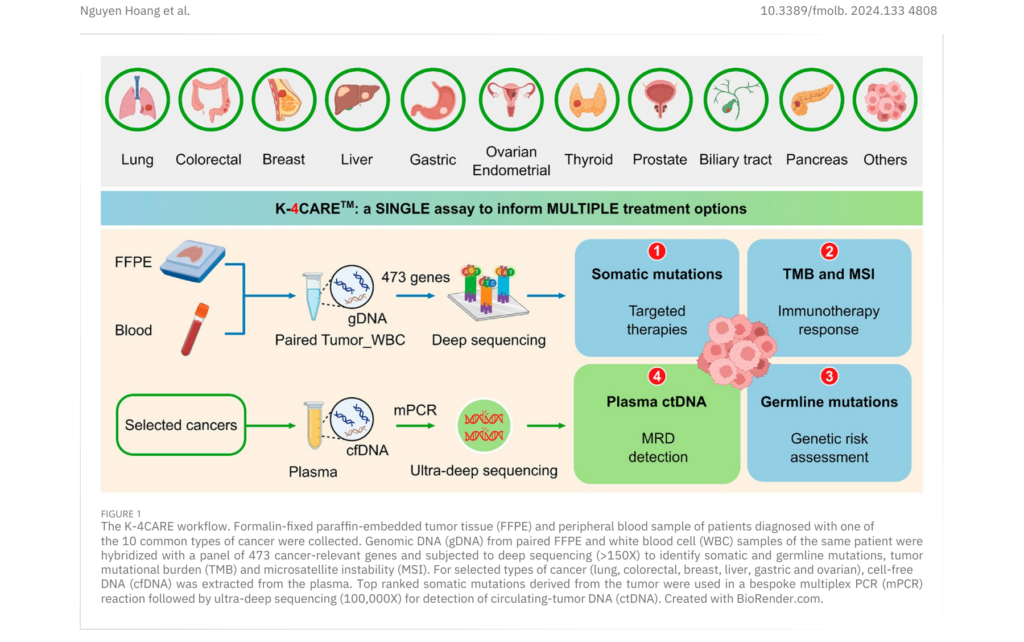
Nghiên cứu về quy trình và ứng dụng xét nghiệm K-4CARE đã được công bố trên tạp chí Frontier of Molecular Bioscience, áp dụng cho khoảng 250 bệnh nhân người Việt Nam. Tóm tắt giải pháp này bằng một thuật ngữ gọi là Pair Tumor_White Blood Cell, tức là so sánh giữa dữ liệu của khối u và dữ liệu của bạch cầu. Kết quả trên 250 bệnh nhân người Việt Nam cho thấy những đột biến thường gặp để điều trị nhắm trúng đích bao gồm cả đột biến đơn nucleotit (SNV) giữa indel và amplification đều cho độ nhạy và độ chuyên >99%.
Ngược lại, đột biến fusion hiện nay có độ nhạy đạt khoảng 94%. Nghiên cứu cũng so sánh những chỉ dấu miễn dịch (Ví dụ: TMB, MSI) bằng phương pháp 473 gen so với chỉ số khảo sát bằng Whole Exome Sequencing, cho độ tương hợp đạt khoảng 97%. Và ngưỡng dương tính khảo sát tồn dư tối thiểu (MRD) trong plasma là > 0.05. Nghiên cứu chỉ ra những đột biến đích (actionable mutation) hay gặp nhất là trong ung thư tuyến giáp, vú, phổi và đại trực tràng. Ngoài ra, mối tương quan khi lượng giá xét nghiệm K-4CARE trên những mẫu chuẩn (mẫu được gửi bởi Illumina) và mẫu của bệnh nhân người Việt Nam cho thấy mức tương hợp về cả đột biến đơn nucleotit và kiểu indel đều đạt rất là khả quan từ 93 – 95%.
Trong bài trình bày của mình, TS. BS Nguyễn Duy Sinh giải thích chi tiết về cơ chế của từng phương pháp thông qua 4 phần tương ứng với 4 kết quả K-4CARE mang tới, giúp các chuyên gia hiểu rõ hơn về ứng dụng của K-4CARE trên lâm sàng.
Ở phần kết luận, TS.BS Nguyễn Duy Sinh đặt ra câu hỏi “Vậy xét nghiệm K-4CARE ứng dụng kỹ thuật CGP này có lợi trong các nhóm bệnh nhân nào? Nếu đứng góc nhìn cá thể hóa, thường là mỗi bệnh nhân họ chỉ dương tính với một trong những chỉ dấu này. Nếu chúng ta tiếp cận theo kiểu cũ, lần lượt làm từng xét nghiệm một, thì nhiều khi bệnh nhân không có đủ thời gian để đợi kết quả. Thứ hai là không có đủ mẫu mô để chúng ta làm hết tất cả các xét nghiệm này. Vậy thì giải pháp nhiều chỉ dấu trong một xét nghiệm CGP sẽ có lợi cho những bệnh nhân mà chúng ta cần phải can thiệp sớm và lựa chọn chính xác các liệu pháp điều trị”
BÀI BÁO CÁO CỦA PGS.TS. BS PHẠM CẨM PHƯƠNG
ỨNG DỤNG CHỈ DẤU MSI TRONG ĐIỀU TRỊ MIỄN DỊCH UNG THƯ ĐẠI-TRỰC TRÀNG
Bài báo cáo của PGS. TS. BS Phạm Cẩm Phương đi chi tiết vào chỉ dấu khảo sát Bất ổn định vi vệ tinh (MSI) ứng dụng trong ung thư đại-trực tràng. PGS. TS. BS Phạm Cẩm Phương chia sẻ “2 khái niệm mà chúng ta hay nhắc đến, đó là MSI – các vùng vệ tinh gồm các chuỗi nucleotit được lặp đi lặp lại nhiều lần và khái niệm “mất ổn định vi vệ tinh” là sự tăng chiều dài của đoạn vi vệ tinh do sự giảm các chức năng sửa chữa ghép cặp sai MMR. Do vậy,hệ thống gen protein của nhóm sửa chữa này (MMR) sẽ gây tích tích tụ dần các sai sót DNA (MSI) và từ đó là hình thành nên các đột biến và sẽ tiến triển thành ung thư.”
Chỉ dấu Bất ổn định vi vệ tinh (MSI) đa số hay gặp trong ung thư đại-trực tràng, ung thư buồng trứng, ung thư dạ dày và một số các loại bệnh ung thư khác như là ung thư thực quản, ung thư biểu mô tế bào gan. Các nghiên cứu trên thế giới cũng cho thấy các khối u của đường tiết niệu, các khối u của đại-trực tràng, các khối u ở dạ dày là những khối u có tình trạng bất ổn định vi vệ tinh cao. Tình trạng Bất ổn định vi vệ tinh (MSI) có sự khác nhau giữa vị trí khối u và giai đoạn ung thư (Ví dụ: Khối u ở bên phải có tình trạng bất ổn định vi vệ tinh cao hơn so với các khối u ở vùng đại tràng bên trái. Ví dụ: Ở giai đoạn sớm, tỷ lệ bất ổn định vi vệ tinh cao hơn so với giai đoạn muộn. Và những bệnh nhân có bất ổn định vi vệ tinh cao (MSI-H) ở giai đoạn sớm thường có tiên lượng tốt hơn, khả năng di căn thấp hơn. Còn ở giai đoạn muộn, khi có tình trạng bất ổn định vi vệ tinh cao là một trong những dấu ấn để chúng ta lựa chọn các phương pháp điều trị miễn dịch cho người bệnh ở giai đoạn này).
Riêng đối với ung thư đại-trực tràng, xét nghiệm bộc lộ Protein MMR/MSI có ý nghĩa như thế nào trên lâm sàng? Những chỉ dấu này có giá trị sàng lọc trong những trường hợp:
- Những bệnh nhân ung thư đại tràng xuất hiện bệnh ở lứa tuổi trẻ thường là < 40-50, hoặc là trong gia đình có những người mà có hội chứng Lynch, thì chúng ta cần phải đánh giá xem là người bệnh có sự thiếu hụt của MMR này hay không.
- Những bệnh nhân ung thư đại-trực tràng ở giai đoạn II/III, chúng ta có thể xét nghiệm để đánh giá liệu rằng có cần thiết phải điều trị bổ trợ hay không và đặc biệt là cân nhắc liệu pháp điều trị bổ trợ bằng 5-FU.
- Ở giai đoạn muộn chúng ta cần làm xét nghiệm để đánh giá xem người bệnh có đáp ứng với thuốc điều trị bằng miễn dịch hay không.
PGS. TS. BS Phạm Cẩm Phương giới thiệu một số phương pháp để khảo sát tình trạng Bất ổn định vi vệ tinh cao (MSI-H) hay sự biểu lộ của hệ thống sửa chữa bắt cặp sai (MMR):

Có rất nhiều phương pháp để khảo sát tình trạng Bất ổn định vi vệ tinh (MSI) như hóa mô miễn dịch, PCR, NGS. Trong đó theo bác sĩ Phương, đối ung thư đại-trực tràng hay là ung thư nội mạc tử cung chúng ta có thể sử dụng 1 trong 3 phương pháp trên. Tuy nhiên một số các bệnh lý hiếm gặp khác chúng ta nên sử dụng phương pháp NGS hơn.
Thông qua 1 số ca lâm sàng, PGS. TS. BS Phạm Cẩm Phương cho thấy rằng ý nghĩa của việc xét nghiệm cả 3 chỉ dấu: MSI, TMB và PD-L1. Đối với những bệnh nhân có tình trạng MSI-H, TMB cao, có bộc lộ PD-L1 cao và có sự xâm nhập của các tế bào lympho, đây là những yếu tố giúp chúng ta tiên lượng được xem người bệnh này sẽ đáp ứng với các liệu pháp điều trị bằng miễn dịch hay không.
Nói tóm lại, đối với bệnh ung thư đại-trực tràng thì việc chúng ta đánh giá sự bất ổn định vi vệ tinh (MSI) là cần thiết, đặc biệt là đối với những bệnh nhân ở giai đoạn sớm và trẻ tuổi, để từ đó có các tư vấn di truyền phù hợp.
Còn ở giai đoạn muộn thì chúng ta sẽ đánh giá xem người bệnh có hiệu quả đối với các phương pháp điều trị miễn dịch hay không và sẽ tư vấn, hướng dẫn và tiên lượng được rằng người bệnh sẽ có đáp ứng với các liệu pháp điều trị miễn dịch. Còn ở giai đoạn II/III sẽ hỗ trợ bác sĩ xem xét đến liệu pháp điều trị bổ trợ có hoặc không có 5-FU.
BÀI BÁO CÁO CỦA PGS. TS. BS LÊ THƯỢNG VŨ
VAI TRÒ CỦA TMB TRONG UNG THƯ PHỔI KHÔNG TẾ BÀO NHỎ VÀ ỨNG DỤNG CỦA ctDNA TRONG VIỆC ĐÁNH GIÁ ĐÁP ỨNG ĐIỀU TRỊ CỦA LIỆU PHÁP TKI VÀ MIỄN DỊCH
Theo GLOBOCAN 2020, ở Việt Nam ung thư phổi đứng thứ 2 sau ung thư gan, nhưng trên thế giới ung thư phổi là bệnh có tỉ lệ mắc và tử vong hàng đầu. Trong khi đó tại châu Á, hầu hết ung thư phổi có tỷ lệ mới mắc, cho tới tử vong cao hơn phần còn lại của thế giới.
Nguyên nhân khiến tình hình ung thư phổi không mấy khả quan là do việc tiếp cận điều trị rất khó khăn vì tính chất không có nhiều triệu chứng, do đó bệnh thường được phát hiện lúc giai đoạn muộn và tử suất cao, trong khi chỉ những bệnh nhân giai đoạn sớm thì mới có thể phẫu thuật và xạ trị được. Chính vì vậy, những liệu pháp điều trị nội khoa ung thư bao gồm là hóa trị, liệu pháp nhắm trúng đích, liệu pháp miễn dịch sẽ được ứng dụng trong cả những giai đoạn sớm lẫn trong giai đoạn muộn với hy vọng tăng tỉ lệ sống còn.
PGS. TS. BS Lê Thượng Vũ cũng chỉ ra những thay đổi về cách nhìn nhận bệnh ung thư phổi trong thời gian qua. Ban đầu ung thư phổi không tế bào nhỏ được coi là một loại bệnh đơn lẻ, bây giờ mình biết thêm rằng có rất là nhiều loại NSCLC như ung thư biểu mô tế bào vảy, ung thư biểu mô tuyến, cho đến ngày nay NSCLC còn được phân nhóm nhỏ thành từng loại phân tử khác nhau. Do đó, chúng ta thấy được lợi ích của những xét nghiệm đa gen như oncoGS và K-4CARE đang phát triển. Bác sĩ cũng nhận định trong tương lai sẽ làm cả DNA, RNA và Protein thay vì quy trình hiện nay là làm xét nghiệm những gen kinh điển.
Trong 1 nghiên cứu đã được báo cáo vào năm 2020, chúng ta có thể nhìn tổng quan về ứng dụng của ctDNA để theo dõi điều trị, tiến triển của khối u và mới nhất có thể phát hiện tính không đồng nhất của khối u.
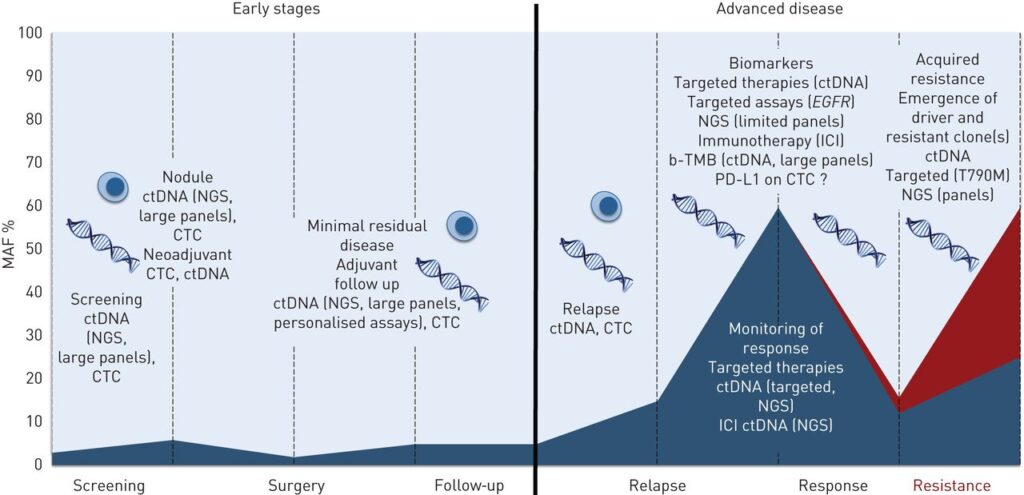
Đầu tiên là ứng dụng trong sàng lọc ung thư (screening) bằng ctDNA. Theo bác sĩ, có thể ứng dụng lâm sàng tại Việt Nam trong 1 số trường hợp như người hay hút thuốc lá mà trong gia đình có 1 người bị ung thư ở thế hệ 1, thay vì sàng lọc bằng CT scan liều thấp nhiều lần có nguy cơ bị phơi nhiễm phóng xạ, thì trong trường hợp này có thể sàng lọc ung thư bằng ctDNA. Ngoài ra sàng lọc ung thư phổi bằng ctDNA có thể phân loại bệnh nhân theo nhóm nguy cơ thấp, trung bình, cao một cách rõ nét hơn.
Ở những bệnh nhân có thể phẫu thuật, các bác sĩ điều trị đa phần dựa theo giai đoạn là chính. Đối với bệnh nhân giai đoạn II – III thì hầu như chúng ta sẽ tiến hành điều trị bổ trợ hoặc là bằng miễn dịch. Nhưng bệnh nhân ở giai đoạn IA rất dễ gây tranh cãi, vì chỉ có những bệnh nhân nguy cơ cao thì mới tiến hành điều trị được. Vậy chúng ta có thể định nghĩa nhóm bệnh nhân IA nguy cơ cao như thế nào? Một trong những cách đó là theo dõi chỉ dấu ctDNA.
Tới giai đoạn tiến xa, thông thường thì bác sĩ sẽ đánh giá theo RECIST như u nhỏ là đáp ứng tốt, u to là không đáp ứng tốt và có nguy cơ kháng thuốc. Thực tế thì ở thời điểm hiện tại chưa có khuyến cáo, hướng dẫn nào bắt buộc phải làm ctDNA ở giai đoạn bệnh này. Nhưng ví dụ khi ctDNA được làm song song với các xét nghiệm thường quy như CT đầu ngực bụng, mà mình thấy CT đầu ngực bụng cho thấy có đáp ứng, nhưng ctDNA lại dương. Vậy khi đó các bác sĩ có thể sẽ cân nhắc làm thêm PET CT hoặc bộ xạ hình xương hoặc là đánh giá thêm những chỗ di căn nào mà mình bỏ sót. Như vậy thì chúng ta có thể thấy lợi ích của ctDNA giúp cho bác sĩ có thêm góc nhìn trong việc đánh giá đáp ứng điều trị của bệnh nhân.
Ngoài ra, ctDNA có thể phát hiện được những đột biến kháng thuốc (Ví dụ: T790M). Ngày trước thường các bác sĩ không biết bệnh nhân có gen kháng thuốc và cho đến khi bệnh nhân bị kháng thuốc rồi mới thay đổi liệu pháp điều trị. Nhưng với kết quả của nghiên cứu FLAURA 2 thì chúng ta có thể thấy với những bệnh nhân được biết có đột biến kháng thuốc ngay từ đầu, thì việc phối hợp hóa trị với Osimertinib sẽ mang lại lợi ích cho bệnh nhân hơn. Với thông tin này, bác sĩ lâm sàng sẽ đưa ra quyết định điều trị chính xác ngay từ đầu, từ đó giúp tăng khả năng đáp ứng điều trị.
Ở phần tiếp theo, PGS. TS. BS Lê Thượng Vũ phân tích sâu hơn về chỉ dấu TMB. Đã có những nghiên cứu được FDA phê duyệt có thể sử dụng liệu pháp miễn dịch (pembrolizumab) để điều trị cho bệnh nhân ung thư khi chỉ dấu TMB cao.
Về ứng dụng của TMB, một bài báo cáo của tác giả người Ý thực hiện ở hơn 1552 bệnh nhân ở Dana Fiber của Memorial Sloan Kettering Center, cho thấy kết quả TMB-High nghĩa là bệnh nhân sẽ có khả năng đáp ứng tốt và tăng tỉ lệ sống còn với liệu pháp điều trị miễn dịch.
Trong phần kết luận, PGS. TS. BS Lê Thượng Vũ cho rằng việc điều trị ung thư phổi hiện nay còn rất nhiều khó khăn. Nếu muốn điều trị cá thể hóa tốt, thì trước hết là cần chẩn đoán chính xác đột biến để lựa chọn chính xác liệu pháp điều trị nhắm trúng đích, bên cạnh đó là dựa vào các chỉ dấu miễn dịch (TMB, MSI, PD-L1) cho lựa chọn liệu pháp điều trị miễn dịch. Sau đó là đánh giá ctDNA để theo dõi đáp ứng điều trị.
BÀI BÁO CÁO CỦA TS. NGUYỄN HOÀI NGHĨA
NGHIÊN CỨU LÂM SÀNG THÚC ĐẨY Y HỌC CHÍNH XÁC
Nhằm góp phần thúc đẩy Y học chính xác cũng như Y học Cá thể hóa trong điều trị ung thư, Viện di truyền y học cũng như Gene Solutions đề xuất các nghiên cứu lâm sàng.
Ước lượng chỉ có 30% bệnh nhân có đáp ứng với điều trị Immune checkpoint inhibitors – ICI. Do đó bên cạnh nghiên cứu các chỉ dấu quan trọng trong liệu pháp điều trị miễn dịch đã có, vai trò kết hợp của các chỉ dấu này thì các chỉ dấu mới cũng cần được đánh giá, do đó TS Nghĩa đề xuất 3 giải pháp sau:
- Đánh giá lượng giá một cách đồng thời hoặc độc lập các chỉ dấu hiện nay đã được sử dụng là PD-L1, MSI, TMB cũng như động học ctDNA giúp điều trị ung thư chính xác tốt hơn.
- Chỉ dấu mới được xem rất tiềm năng cho dự đoán đáp ứng điều trị miễn dịch: TNB, microbiome, TIL. Ở đây một khái niệm mới là TNB, tức là đánh giá dựa trên tumor neoantigen burden – chỉ dấu cho thấy số lượng các kháng nguyên thực sự được trình diện tế bào ung thư chứ không phải chỉ riêng đột biến. Đây chính là một khái niệm mới, một chỉ dấu mới mà chúng ta có thể cân nhắc để giúp cho việc dự đoán điều trị đã tốt hơn hay chưa. Góc thứ 2 đó chính là microbiome, tức là hệ vi sinh đường ruột được xem là một chỉ dấu cũng rất là hấp dẫn. Tại vì các vi sinh vật nó sẽ sản xuất ra các metabolism tức là các chất trao đổi chất, những chất này có thể tác động lên sự đáp ứng của miễn dịch cũng như ức chế các điều trị. Góc thứ 3 là TIL, tức là viết tắt của Tumor-infiltrating lymphocytes, chúng ta có thể đánh giá, thậm chí có thể giải trình tự TCR (T-cell receptor) đi vào được bên trong khối u hay không. Nói một cách nôm na là chúng ta lượng giá định lượng được T-cell bên trong mô u. Đây cũng là chỉ dấu quan trọng giúp chúng ta dự đoán được đáp ứng, điều trị tốt hơn cho bệnh nhân.
- Bên cạnh đó cũng cần đánh giá các chỉ dấu cho điều trị thường quy: HRR, HRD, động học ctDNA.
Các nghiên cứu phần 2 là các lượng giá cho vai trò của ctDNA, qua các bài báo cáo chúng ta đã thấy được ctDNA có vai trò từ bước trước phẫu thuật triệt căn cho đến theo dõi đáp ứng, theo dõi phát hiện các tồn dư tối thiểu (MRD) của khối u cho đến các bước trong suốt quá trình tái phát và di căn.
- Đề xuất đầu tiên được xem là một hướng rất phổ biến và đã có rất nhiều các chứng cứ hỗ trợ cho vai trò của ctDNA trong việc phát hiện các tồn dư tối thiểu khối u (MRD) để dự đoán sớm, phát hiện sớm các tái phát của điều trị. Những nghiên cứu này có thể tiến tới mức mà hiện nay chúng ta có thể làm được real-world monitoring cho các loại ung thư khác nhau.
- Đề xuất thứ 2 được xem là một nghiên cứu lớn và cần sự tham gia của nhiều đơn vị. Đó là RCT – đánh giá vai trò của ctDNA thực chất có quyết định cho điều trị hỗ trợ hay không.
- Đề xuất cuối cùng đó là ứng dụng ctDNA đánh giá đáp ứng điều trị ở bước tân bổ trợ.
THẢO LUẬN
Câu hỏi 1: Hiện nay trên thế giới có 2 xét nghiệm được FDA phê duyệt để khảo sát CGP sử dụng panel gen khoảng 300 – 400 gen, tại sao Gene Solutions lại đưa ra giải pháp K-4CARE với panel lớn hơn 473 gen? Không biết Gene Solutions có đặc điểm hay mục đích gì không?
TS.BS Nguyễn Duy Sinh: Trong xét nghiệm CGP này, chúng ta quan tâm nhiều nhất chính là TMB (Total mutational burden), tức là tổng gánh nặng đột biến của khối u. Mà muốn đo được tổng đột biến khối u thì các tiêu chuẩn quy ước là tổng số gen mình khảo sát khi tính ra chiều dài DNA phải trên 1 Mb.
Cho nên đó là lý do tại sao 2 xét nghiệm đó sử dụng panel gen thường là khoảng trên 300 – 400, khi cộng lại thì tổng chiều dài là khoảng 1 Mb. Và TMB-H được xác định trên một chiều dài 1Mb, tức là phải tìm được > 10 đột biến thì mới được xác định là TMB-High, tức là số đột biến xảy ra trên những genome quá cao thì mình gọi là tăng tổng tải lượng đột biến và TMB.
Còn riêng với giải pháp K-4CARE của Gene Solution, bên cạnh lý do tại sao sử dụng panel gen lên đến 473 theo quy ước, thì trong quá trình phát triển giải pháp này, chúng tôi muốn ứng dụng cho cả phân loại phân tử của một số subtype của một số ung thư mới, đặc biệt là ung thư phụ khoa, ví dụ như ung thư nội mạc tử cung, hay là một số gen ung thư hiếm gặp ví dụ như là melanom, hoặc là Lymphoma cho nên là đội ngũ phát triển đã bổ sung thêm một số gen mới vào để phủ hầu như tất cả các u đặc mà thường thấy ở Việt Nam, vì giải pháp của mình phát triển sau những xét nghiệm tiền nhiệm, cho nên là danh sách gen (Panel gen) sẽ tăng lên đáng kể.
Câu hỏi 2: Trong xét nghiệm CGP, ngoài khảo sát đột biến đích đã phổ biến và các bác sĩ đã hiểu rõ về liệu pháp nhắm trúng đích, thì 2 chỉ dấu MSI và TMB có ý nghĩa như thế nào trên lâm sàng?
GS. Nick Pavlakis: 2 chỉ dấu này giúp đánh giá tình trạng bất ổn định vi vệ tinh (MSI) và gánh nặng đột biến khối u (TMB) – những yếu tố tiên đoán khả năng đáp ứng với liệu pháp miễn dịch của bệnh nhân.
Trong ung thư phổi, TMB chưa cho thấy kết quả thống nhất, do đó PD-L1 vẫn là lựa chọn được ưu tiên vì dễ dàng thực hiện hơn trong thực hành lâm sàng. Tuy nhiên, đối với các ung thư đường tiêu hóa, MSI-H được biết đến là yếu tố tiên đoán quan trọng về hiệu quả của liệu pháp miễn dịch.
Vì vậy, trong trường hợp ung thư đường tiêu hóa, tôi sẽ sử dụng nền tảng CGP để đánh giá MSI-H và TMB, từ đó đưa ra phác đồ điều trị phù hợp. Tóm lại, MSI-H và TMB được dùng để đánh giá mức độ mất ổn định di truyền và khả năng đáp ứng miễn dịch của bệnh nhân.
Câu hỏi 3: Trong những trường hợp MSI-H thì đa phần những nghiên cứu cho thấy là tiên lượng tốt, tại sao nó lại như vậy?
TS.BS Nguyễn Duy Sinh: Khi MSI-High dễ gây ra đột biến, mà nguyên tắc là khi xuất hiện đột biến mới, tạo kháng nguyên mới thì hệ thống miễn dịch sẽ kích hoạt. Cho nên là ở giai đoạn sớm thì bệnh nhân sẽ có tiên lượng tốt là tại vì hệ miễn dịch đang hoạt động tốt, nhưng mà lâu dài thì hệ miễn dịch sẽ bị suy yếu đi, thì ngược lại thì lúc đó ở giai đoạn tiến xa thì khối u tăng biểu hiện chốt miễn dịch, lại có lợi với điều trị miễn dịch, ví dụ như là ICI, tức là giai đoạn sớm thì mới tiên lượng tốt.
Câu hỏi 4: Lâu nay các nhà lâm sàng đánh giá đáp ứng điều trị với các khối u đặc theo RECIST, bây giờ có thêm xét nghiệm ctDNA để đánh giá MRD, vậy ctDNA có những tương thích như thế nào với hình ảnh trên lâm sàng? Và nếu như mà còn tồn dư tối thiểu (MRD) trong máu thì ở mức độ nào chúng ta nên theo dõi hay là tiếp tục điều trị? Và điều trị đến bao lâu, đến mức độ nào thì ngưng? Có khuyến cáo nào cho các nhà lâm sàng để điều trị những trường hợp đó hay không?
TS.BS Nguyễn Duy Sinh: Liên quan đến khảo sát ctDNA trong trong máu được định nghĩa dương tính là khi > 0.05, có nghĩa là nếu mình phát hiện ra 10.000 alen trong máu mà trong đó có 5 alen đột biến giống như đột biến xuất hiện theo khối u thì gọi là dương tính. Khi kết quả dương tính lúc mình đang còn điều trị, như vậy thì mình được phép thay đổi phác đồ điều trị hay không? Thời điểm hiện tại chúng ta chưa có bằng chứng khi xét nghiệm dương tính thì chúng ta có được thay đổi phác đồ điều trị hay không. Tuy nhiên, thực tế trên lâm sàng cho thấy kết quả này có ý nghĩa giúp cho các bác sĩ thêm thông tin, đặc biệt là ở nhóm bệnh nhân nguy cơ tái phát trung bình chúng ta đang băn khoăn không biết có nên điều trị hỗ trợ hay không. Ngoài ra, một số trường hợp thì các bác sĩ lâm sàng có thể cân nhắc kết hợp thêm liệu pháp (Ví dụ như điều trị bằng TKI khi động năng ctDNA không giảm, khi đó có thể cân nhắc bổ sung thêm bằng hóa trị hoặc là kết hợp giữa hóa trị với miễn dịch). Còn nếu mình chỉ dùng ctDNA để theo dõi thì khi mà xét nghiệm dương tính, mình cần cân nhắc việc khảo sát xem thực sự là bệnh nhân có tái phát hay không, vẫn phải kết hợp với lâm sàng để đánh giá lại rồi mới quyết định được có nên thay đổi điều trị của mình hay không.
Câu hỏi 5: Theo GS. Nick thì xét nghiệm CGP chỉ dùng cho bệnh nhân ở giai đoạn muộn hay là dùng cho cả bệnh nhân ở giai đoạn sớm?
GS. Nick Pavlakis: Hiện tại, đa số các trường hợp ung thư sử dụng CGP nhằm hỗ trợ đưa ra quyết định điều trị đặc hiệu thường nằm ở giai đoạn di căn. Tuy nhiên, CGP cũng có thể được dùng ở giai đoạn sớm để đánh giá tồn dư tối thiểu (MRD) nhằm xác định sự tồn tại của tế bào ung thư và đưa ra các quyết định tăng cường hoặc giảm liều liệu pháp hỗ trợ (hỗ trợ hoặc tân hỗ trợ). Chúng ta vẫn cần thêm dữ liệu từ các thử nghiệm lâm sàng để hiểu rõ hơn cách sử dụng thông tin từ CGP ở giai đoạn sớm của bệnh. Nhưng đối với các trường hợp tiến triển, CGP đóng vai trò then chốt.
Đối với Ung thư đại trực tràng: Một nghiên cứu tại Úc, được công bố trên New England Journal, đã sử dụng MRD để phân tầng bệnh nhân ung thư đại trực tràng giai đoạn sớm nhằm đưa ra hướng điều trị hỗ trợ tối ưu. Một số nghiên cứu khác cũng đang đánh giá vai trò tương tự của MRD. Mặc dù cần thêm dữ liệu trong các loại ung thư khác, tôi tin rằng các hướng nghiên cứu này sẽ sớm cho ra kết quả đầy hứa hẹn. Do đó, hiện tại CGP vẫn chủ yếu được sử dụng để lựa chọn phác đồ điều trị ở giai đoạn bệnh tiến triển hoặc di căn.
Câu hỏi 6: Thách thức của giải trình tự RNA ở thời điểm hiện tại là gì? Và Chi phí ở Úc cho giải trình tự DNA + RNA so với riêng DNA khác nhau như thế nào?
GS. Nick Pavlakis: Đã nhiều năm trôi qua, Chung ta vẫn đang bàn về giá trị gia tăng của việc mở rộng panel CGP từ DNA sang RNA. Lý do là vì RNA có thể phát hiện các đột biến mà DNA bỏ sót, đặc biệt là các trường hợp tái cấu trúc gen (fusions) thường gặp trong ung thư phổi. Không phải tất cả các đột biến này đều là các oncogene điển hình. Chúng ta có các RET fusions, NTRK và nhiều loại khác.
Do đó, để đạt được hiệu quả chẩn đoán tối ưu, panel xét nghiệm cần được lựa chọn phù hợp với từng loại ung thư nghi ngờ và các bất thường di truyền cụ thể. Đối với các đột biến phổ biến trong ung thư phổi, việc sử dụng panel kết hợp DNA + RNA là giải pháp tối ưu. Tuy nhiên, với các loại ung thư khác, có thể không cần thiết phải sử dụng nền tảng phức tạp này.
Chi phí khảo sát DNA + RNA khá là cao vì vậy điều quan trọng là chúng ta cần thảo luận với các bác sĩ giải phẫu bệnh và các đơn vị xét nghiệm để thiết kế các panel hiệu quả, tiết kiệm chi phí và đáp ứng được nhu cầu chẩn đoán chính xác.
Câu hỏi 7: Thách thức hiện nay khi sử dụng CGP tại Úc là như thế nào?
GS. Nick Pavlakis: Thách thức thứ nhất: Đủ mô bệnh phẩm. Để áp dụng rộng rãi CGP, chúng ta cần thay đổi cách thức chẩn đoán. Sinh thiết chọc hút kim nhỏ (FNA) lấy lượng mô không đủ là không thể thực hiện được. Nếu nghi ngờ ung thư phổi, cần làm sinh thiết với phương pháp tối ưu ngay đầu tiên: sinh thiết lõi kim (core biopsy) bằng nội soi phế quản hoặc trên nền siêu âm vẫn cho chất lượng DNA khá tốt. Mặc dù các kỹ thuật tế bào học đang được cải thiện, nhưng quan trọng nhất là thảo luận với các bác sĩ giải phẫu bệnh để chọn đúng phương pháp lấy mô. Đây là thách thức đầu tiên và lớn nhất.
Thách thức thứ hai: Mạng lưới phòng thí nghiệm. Khi đã có đủ mô, chúng ta cần tiếp cận các phòng thí nghiệm được trang bị đầy đủ và có quy trình xét nghiệm được kiểm định chặt chẽ. Ngoài nghiên cứu lâm sàng, tôi hiện sử dụng một nền tảng CGP thương mại – Úc có một số lựa chọn cho cả mô và mẫu sinh thiết lỏng – phù hợp với bệnh nhân có khả năng chi trả. Nghiên cứu của chúng tôi hy vọng cung cấp cơ sở dữ liệu thuyết phục chính phủ cấp kinh phí, giúp CGP được áp dụng rộng rãi cho tất cả bệnh nhân. Chúng tôi mong đợi các kết quả này trong 1-2 năm tới. Vấn đề cốt lõi là: xét nghiệm càng nhiều, chi phí sẽ giảm, phòng thí nghiệm càng thành thạo. Tuy nhiên, cần có sự tiêu chuẩn hóa và kiểm soát chất lượng đối với các kết quả xét nghiệm.
Một thách thức nữa là yêu cầu tổ chức các buổi thảo luận đa chuyên khoa (MDT) để diễn giải kết quả CGP.
Câu hỏi 8: Đối với ung thư đại trực tràng thì khảo sát cả MSI, Germline và MDR có lợi ích như thế nào?
TS.BS Phan Thị Hồng Đức: Tôi có 1 buổi thảo luận với một chuyên gia đầu ngành về tiêu hóa rất và nổi tiếng ở Anh thì tôi có hỏi về của ung thư đại trực tràng, ví dụ như một bệnh nhân ung thư đại trực tràng giai đoạn sớm, sau đó người ta tái phát di căn mà mẫu bệnh phẩm ban đầu không có đem ra test được MMR được thì lúc đó sẽ làm thế nào? Ông nói là lúc đó là mình sẽ có ctDNA, mình sẽ đánh giá được dMMR để mình quyết định điều trị miễn dịch hay là không. Và tôi cũng hỏi rằng là có bất tương hợp giữa tổn thương nguyên phát với tổn thương di căn giống ung thư vú không? Ông nói là trừ những trường hợp hội chứng Lynch thì mới không thay đổi thôi. Tuy nhiên những khác thì vẫn có khả năng thay đổi, thì lúc đó ctDNA sẽ có bộc lộ vai trò của mình trong vấn đề đánh giá dMMR.
Riêng về MRD, lúc trước tôi có làm những bài báo cáo về ung thư đại trực tràng giai đoạn sớm, thì đối với giai đoạn II cũng có những nghiên cứu đánh giá về MRD thì họ thấy là những người mà dùng ctDNA để đánh giá MRD ở giai đoạn sớm mà nó còn dương tính, thì khả năng tái phát di căn sẽ cao hơn, sống còn toàn bộ thấp hơn. Và họ cũng có những nghiên cứu với trường hợp như thế, ngoài điều trị chuẩn, ví dụ như là: Phác đồ CapeOx, phác đồ FOLFOX. Sau đó họ cộng thêm những liệu pháp khác, ví dụ như là Irinotecan. Nếu việc ứng dụng theo dõi ctDNA cho MRD được đưa vào guideline chuẩn Quốc tế như NCCN, ESMO … thì tôi nghĩ sẽ được các bác sĩ lâm sàng ứng dụng rộng rãi hơn.
Câu hỏi 9: Hiện nay ở trong bệnh viện, để khảo sát dMMR thì mình có sử dụng NGS không?
TS. BS Nguyễn Thị Mai Lan: Xét nghiệm trong ung thư đại trực tràng hiện nay của bệnh viện chúng tôi vẫn đang làm hóa mô miễn dịch. Có 2 lý do là chi phí điều trị thì thấp hơn và xét nghiệm hóa mô miễn dịch được hưởng bảo hiểm y tế. Tuy nhiên qua các bài báo cáo hôm nay chúng tôi cũng cũng thấy rõ ràng là có 2 phương pháp để làm MSI hiện nay, đó là hóa mô miễn dịch và NGS. Và qua phân tích của các báo cáo thì thấy rằng NGS sẽ hạn chế được tình trạng dương tính giả, âm tính giả. Và NGS tìm ra được nhiều hậu quả dẫn đến sự bất ổn định vi vệ tinh (MSI).
Câu hỏi 10: Đối với ung thư phổi, có đặc điểm là khó lấy mẫu mô hơn so với các loại ung thư khác. Vậy với những tài liệu, những công trình nghiên cứu mới nhất, giữa lấy mẫu mô và làm ctDNA mẫu máu thì khuyến cáo như thế nào?
PGS.TS.BS Lê Thượng Vũ: Thực ra thì về mặt kinh điển thì người ta vẫn khuyến cáo là mình phải làm sinh thiết. Với những khối u kích thước nó nhỏ rất là khó sinh thiết. Nên chúng tôi có phát triển nhiều kỹ thuật mới: nội soi, sinh thiết xuyên ngực, sinh thiết trên nền siêu âm. Tuy nhiên không phải lúc nào cũng làm được, vì vậy đôi khi thì phải sinh thiết những tổn thương di căn khác giống như là hạch, hoặc là màng phổi, hoặc là xương.
Nhưng cũng không phải trường hợp nào cũng có thể sinh thiết được vì thể trạng bệnh nhân khi bắt đầu tái phát sẽ không mấy khả quan nên để nhẹ nhàng hơn cho bệnh nhân, chúng tôi làm ctDNA. Nếu mà phát hiện được thì có thể chuyển đổi điều trị ngay. Có lẽ là câu trả lời cuối cùng vẫn là cá thể hóa tùy thuộc vào bệnh nhân đó để có thể chỉ định ctDNA hoặc là sinh thiết.
Câu hỏi 11: Ví dụ trên lâm sàng chúng ta chưa thấy hình ảnh của u, nhưng chúng ta xét nghiệm ra chỉ số của ctDNA tăng lên, vậy chỉ dấu ctDNA tăng lên đến bao nhiêu thì chúng ta có thể có nghĩ đến định hướng ta nên điều trị bổ trợ hay không? Thường thì với mức độ bao nhiêu thì chúng ta thấy được được ảnh khối u trên lâm sàng?
TS.BS Nguyễn Duy Sinh: Nồng độ ctDNA, đặc biệt là VAF, liên quan giữa ngưỡng dương tính ctDNA với kích thước khối u, thật ra là người ta đã có nhiều nghiên cứu mà chủ yếu là vẫn là trong ung thư phổi không tế bào nhỏ, vì kích thước khối u thay đổi rất là nhanh.
Ví dụ như của Gene Solutions, VAF là 0.05 hoặc là chỗ khác 0.1 hay là 0.01, thì tương đương với một khối u mình thấy được trên lâm sàng là khoảng 1mm, từ đó trở đi nếu mà động năng ctDNA tăng lên tương ứng với khối u cũng sẽ tăng kích thước lên.
Còn trường hợp nếu mà ctDNA dương tính nhưng chúng ta chưa phát hiện được hình ảnh học, đa phần các khuyến cáo hiện nay chưa đạt được đồng thuận tới mức chúng ta có thể chọn những liệu pháp điều trị mới, nhưng mà chúng ta nên cố gắng kết hợp với lâm sàng, đặc biệt là những hình ảnh có độ phân giải cao để tìm ra những sang thương. Hoặc là chúng ta nghi ngờ những sang thương đó tái phát, thì chúng ta nên cân nhắc nên sinh thiết lại. Đó là cách phối hợp trên lâm sàng hiện tại.
KẾT LUẬN TỪ CHỦ TOẠ
Tôi thấy kỹ thuật giải trình tự gen thế hệ mới (NGS) là một ứng dụng rất mới đặc biệt cho ứng dụng lâm sàng. Thực tế thì chúng ta sẽ biết rằng các bác sĩ lâm sàng hiện nay cần biết về hồ sơ phân tử (molecular profile) trên từng cá thể. Điều này hiện nay trở nên gần như bắt buộc sau năm 2000, sau khi FDA đã đã chấp thuận cho phương pháp điều trị mới là targeted therapy. Tại vì việc ứng dụng điều trị chính xác hay điều trị cá thể hóa đã trở thành bắt buộc cho tất cả các loại ung thư. Các chuyên gia đồng thuận rằng CGP là một kỹ thuật mới cung cấp bức tranh toàn cảnh về sinh học phân tử của khối u, giúp cho các nhà lâm sàng có thể cá thể hóa điều trị cho bệnh nhân.
ĐỒNG THUẬN TỪ CÁC CHUYÊN GIA
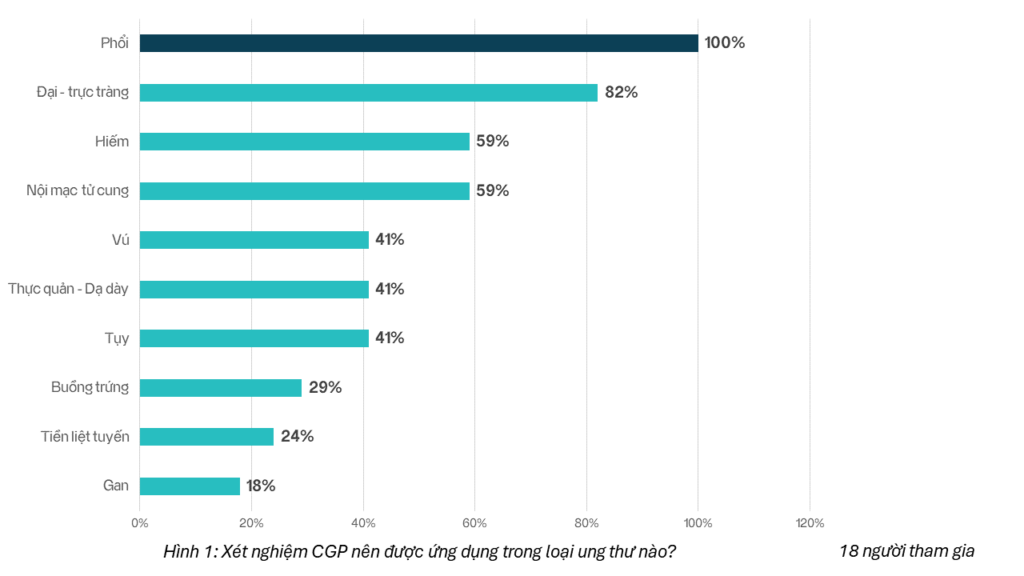
Hình 1: Xét nghiệm CGP nên được ứng dụng trong loại ung thư nào?
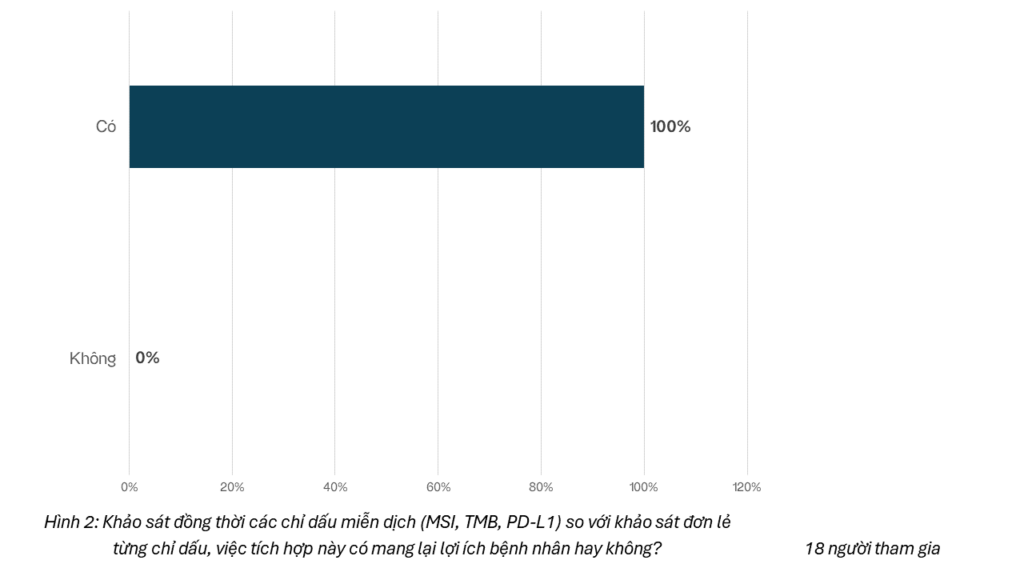
Hình 2: Khảo sát đồng thời các chỉ dấu miễn dịch (MSI, TMB, PD-L1) so với khảo sát đơn lẻ từng chỉ dấu, việc tích hợp này có mang lại lợi ích bệnh nhân hay không?