No products in the cart.
Ung thư là căn bệnh đã cướp đi sinh mạng của hàng ngàn người mỗi năm. Sự không đồng nhất của khối u khiến việc điều trị trở nên phức tạp và khó khăn hơn, việc áp dùng cùng một liệu pháp điều trị, cùng liều lượng cho nhiều bệnh nhân có cùng loại ung thư sẽ không mang lại hiệu quả tối ưu. Điều này đã thúc đẩy sự phát triển của Y học chính xác (precision medicine) hay Y học cá thể hóa (personalized medicine), mở ra cơ hội mới trong việc điều trị ung thư dựa trên đặc điểm riêng của từng bệnh nhân.
Ung thư là một trong những nguyên nhân gây tử vong hàng đầu tại Hoa Kỳ. Năm 2018, có khoảng 1.735.350 ca mới được chẩn đoán và 609.640 ca tử vong do ung thư. Dù có nhiều nỗ lực không ngừng nhằm hiểu và kiểm soát bệnh ung thư, căn bệnh này vẫn là một thách thức lớn đối với ngành y tế toàn cầu, đặc biệt là tại Việt Nam.

Tại sao ung thư lại khó điều trị đến vậy? Lý do nằm ở tính phức tạp và không đồng nhất của khối u. Hiện nay, có hơn 100 loại ung thư khác nhau, xuất hiện ở các cơ quan và mô khác nhau trong cơ thể. Một số loại ung thư, như ung thư đại tràng, ung thư vú và u lympho không Hodgkin, còn được chia thành nhiều loại phụ dựa trên đặc điểm phân tử và hình thái tế bào học. Hơn nữa, các dấu ấn sinh học phân tử của khối u có thể thay đổi tùy theo vị trí và giai đoạn phát triển của ung thư.
Dù có nhiều biến thể, hầu hết các loại ung thư đều được điều trị bằng các phương pháp chung: phẫu thuật, xạ trị, hóa trị và liệu pháp miễn dịch. Một số bệnh nhân chỉ cần một phương pháp, nhưng đại đa số các trường hợp phải kết hợp nhiều phương pháp để tăng hiệu quả điều trị và chống lại khả năng kháng thuốc của ung thư. Phẫu thuật thường được chỉ định cho khối u đặc chưa di căn và nằm ở vị trí có thể tiếp cận. Khi ung thư đã di căn, các phương pháp phức tạp hơn như xạ trị và hóa trị sẽ được áp dụng, những phương pháp này sử dụng phóng xạ liều cao và thuốc để tiêu diệt tế bào ung thư hoặc thu nhỏ khối u. Dù hiệu quả, những phương pháp này có thể gây ra nhiều tác dụng phụ và tổn thương tế bào khỏe mạnh.
Xem thêm: Hiểu về quá trình sinh ung
Trong thập kỷ qua, ngày càng rõ ràng rằng không có hai bệnh ung thư nào ở hai bệnh nhân giống hệt nhau. Điều này khiến mỗi bệnh nhân phản ứng khác nhau với các phương pháp điều trị. Sử dụng một phác đồ cho tất cả các bệnh nhân không chỉ kém hiệu quả mà còn tiềm ẩn nhiều rủi ro không mong muốn. Đây là lý do các mô hình phương pháp điều trị cá thể hóa ngày càng được sử dụng rộng rãi hơn.
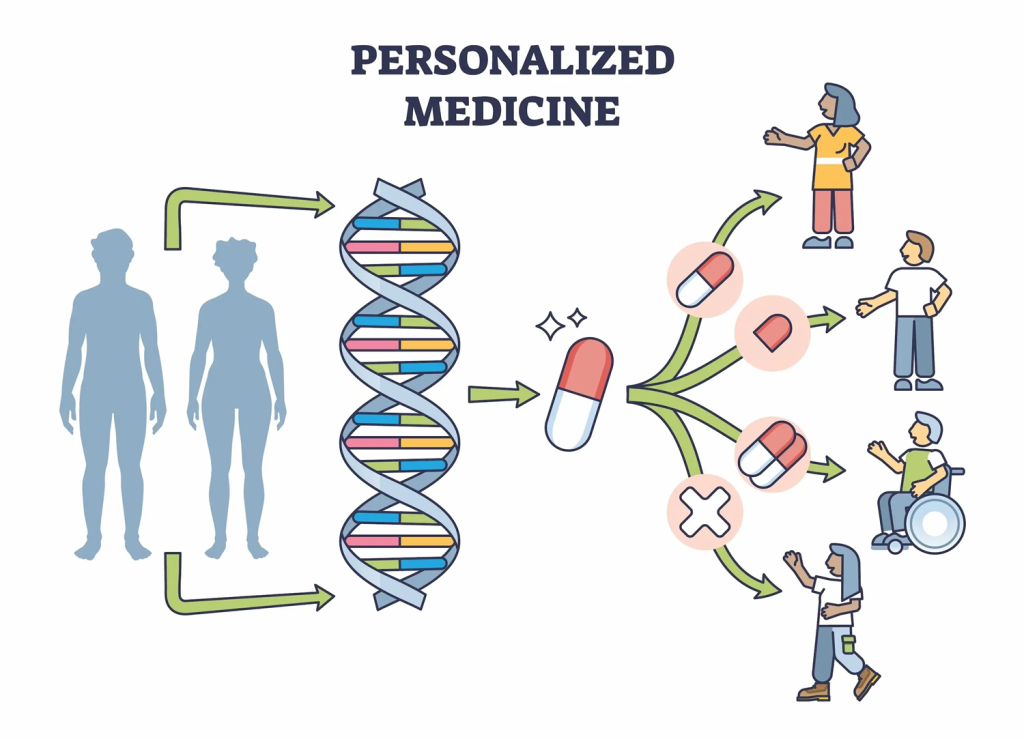
Y học cá thể hóa đã mở ra cơ hội cho các liệu pháp điều trị tối ưu, được thiết kế dựa trên đặc điểm di truyền và sinh học của từng bệnh nhân. Sử dụng các xét nghiệm chẩn đoán đồng hành (CDx) để xác định các dấu ấn sinh học cụ thể trong khối u giúp bác sĩ lựa chọn phương pháp điều trị hiệu quả nhất. Ví dụ, liệu pháp miễn dịch, liệu pháp điều trị nhắm trúng đích vào các dấu ấn sinh học của khối u, mang lại kết quả tích cực và giảm thiểu tác dụng phụ so với các phương pháp truyền thống như hóa trị và xạ trị.
Các tiến bộ trong công nghệ giải trình tự gen và các kỹ thuật omic khác (genomics, proteomics, metabolomics) đã giúp việc thu thập và phân tích dữ liệu di truyền trở nên dễ dàng và chính xác hơn. Điều này cho phép các nhà nghiên cứu và bác sĩ hiểu rõ hơn về cơ chế hoạt động của ung thư và phản ứng của cơ thể đối với các phương pháp điều trị. Nhờ đó, việc phát triển các liệu pháp điều trị cá thể hóa dựa trên dữ liệu cụ thể của từng bệnh nhân đã trở thành hiện thực.
Tuy nhiên, việc tích hợp y học cá thể hóa vào thực hành lâm sàng đòi hỏi sự hợp tác chặt chẽ giữa các nhà khoa học, bác sĩ và các cơ quan quản lý. Cần có sự đầu tư lớn vào nghiên cứu và phát triển, cũng như xây dựng các quy trình tiêu chuẩn để đảm bảo an toàn và hiệu quả của các liệu pháp điều trị mới. Dù còn nhiều thách thức, tiềm năng của y học cá thể hóa trong việc cải thiện chất lượng cuộc sống và kéo dài tuổi thọ cho bệnh nhân ung thư là vô cùng lớn.
Nghiên cứu về ung thư đã đạt được những bước tiến lớn trong những năm gần đây, đặc biệt nhờ vào việc phát hiện và ứng dụng các dấu ấn sinh học. Sự ra đời của các dấu ấn sinh học đã mang đến một cuộc cách mạng trong lĩnh vực ung thư học.
Dấu ấn sinh học (biomarker) là các chỉ số có thể đo lường, dùng để đánh giá các quá trình sinh học, bao gồm sự hiện diện của tế bào ung thư và phản ứng của cơ thể đối với các liệu pháp điều trị. Những dấu ấn này đóng vai trò quan trọng trong việc nâng cao hiểu biết về ung thư và phát triển các chiến lược điều trị cá thể hóa. Hiện nay, các biomarker liên quan đến ung thư bao gồm: biomarker hóa sinh và biomarker sinh học phân tử. Các biomarker này đóng vai trò quan trọng trong chẩn đoán, tiên lượng và điều trị ung thư.
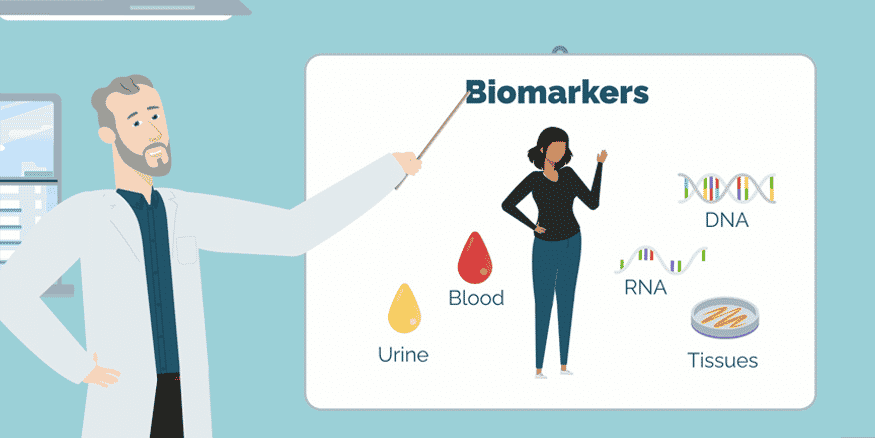
Biomarker sinh hóa là các chất sinh học có thể được đo lường trong cơ thể như máu, nước tiểu, hoặc mô. Các biomarker này bao gồm:
Biomarker sinh hóa giúp phát hiện sự hiện diện của ung thư, theo dõi tiến triển bệnh, và đánh giá hiệu quả của điều trị. Chúng cung cấp thông tin quan trọng cho các bác sĩ trong quá trình chẩn đoán và quản lý bệnh nhân.
Khác với biomarker hóa sinh, biomarker sinh học phân tử liên quan đến các đặc điểm di truyền và phân tử như DNA, RNA và protein. Những biomarker này giúp xác định và phân tích các thay đổi phân tử trong các tế bào ung thư. Các loại biomarker sinh học phân tử chính bao gồm:
Biomarker sinh học phân tử được ứng dụng rất nhiều trong ung thư học, cụ thể:
Biomarker sinh học phân tử giúp nâng cao khả năng chẩn đoán và điều trị ung thư, đặc biệt là trong việc phát hiện sớm và điều trị cá nhân hóa.
Nhìn chung, dấu ấn sinh học (biomarker) đem lại rất nhiều lợi ích giúp chẩn đoán chính xác loại ung thư, theo dõi tiến triển của bệnh và đánh giá hiệu quả điều trị. Việc áp dụng các dấu ấn sinh học đã mở ra một kỷ nguyên mới trong y học, từ đó, các liệu pháp điều trị cũng được thiết kế riêng biệt dựa trên đặc điểm sinh học và di truyền của từng cá nhân cụ thể.
Trong số nhiều dấu ấn sinh học, ctDNA đóng vai trò cực kỳ quan trọng trong y học cá thể hóa. ctDNA (Circulating tumor DNA) là các phân mảnh DNA từ tế bào ung thư thải vào máu. Thông thường, DNA trong máu xuất hiện do nhiều nguyên nhân khác nhau, chủ yếu từ quá trình tự chết theo lập trình của tế bào (apoptosis). Tuy nhiên, ở người bệnh ung thư, khi khối u phát triển, trong máu sẽ xuất hiện thêm một loại DNA đặc biệt gọi là ctDNA.
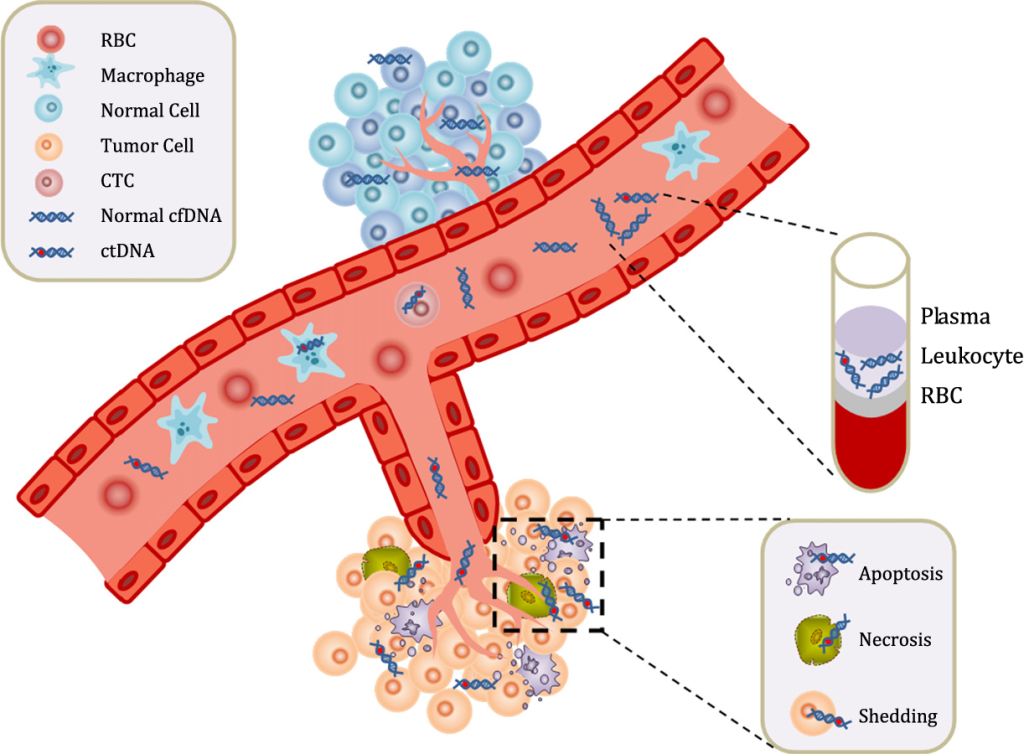
Nếu phát hiện ctDNA trong máu, có khả năng người đó đang mắc ung thư. Sự hiện diện của ctDNA còn giúp các nhà khoa học và bác sĩ theo dõi và phân tích đột biến đích, đột biến kháng thuốc, đặc điểm sinh học phân tử của khối u, từ đó đưa ra phương pháp điều trị cá thể hóa phù hợp với từng bệnh nhân.
ctDNA cũng có thể được sử dụng để theo dõi tiến triển bệnh và đánh giá hiệu quả điều trị. Thay đổi nồng độ ctDNA trong máu phản ánh sự thay đổi của khối u, giúp bác sĩ điều chỉnh phác đồ điều trị kịp thời, tối ưu hóa hiệu quả và giảm thiểu tác dụng phụ.
Một lợi thế lớn của ctDNA là khả năng cung cấp thông tin chi tiết về khối u định kỳ mà không cần sinh thiết xâm lấn. Phương pháp xét nghiệm ctDNA, hay còn gọi là sinh thiết lỏng, có thể thực hiện qua mẫu máu, giúp giảm đau đớn và rủi ro cho bệnh nhân. Điều này đặc biệt quan trọng đối với những bệnh nhân có khối u khó tiếp cận hoặc không thể thực hiện sinh thiết truyền thống.
Xem thêm: Giải mã thông tin chi tiết về ctDNA
Phân tích ctDNA đã trở thành công cụ quan trọng trong việc tầm soát sớm các loại ung thư. Việc phát hiện ctDNA trong máu có thể nhận diện các khối u nhỏ trước khi chúng phát triển lớn và lan rộng, đặc biệt hữu ích cho khối u ở vị trí mà khó phát hiện sớm bằng các phương pháp truyền thống như hình ảnh học hoặc sinh thiết mô.
Xét nghiệm tầm soát sớm ung thư mang lại lợi ích to lớn cho nhân loại, thu hút nhiều công ty đầu tư mạnh vào lĩnh vực này. Một ví dụ tiêu biểu là nghiên cứu của Cohen và cộng sự vào năm 2018 với xét nghiệm “CancerSEEK”. Xét nghiệm này nhắm vào các loại ung thư khó sàng lọc, sử dụng một bảng 61 đoạn khuếch đại để phân tích mẫu máu, phát hiện các đột biến phổ biến trong nhiều loại ung thư như vú, đại trực tràng, thực quản, gan, phổi, buồng trứng, tụy và dạ dày.
Tại Việt Nam, Viện Di truyền Y học Gene Solutions đã phát triển xét nghiệm tầm soát sớm đa ung thư thông qua ctDNA. Xét nghiệm này được gọi là SPOT-MAS, sử dụng các đặc điểm của ctDNA như methylation DNA, số lượng bản sao DNA, kích thước mảnh ctDNA, và mô típ chuỗi tại cuối các đoạn ctDNA để phát hiện và định vị chính xác nguồn gốc của khối u bằng công nghệ máy học (Machine Learning). SPOT-MAS ra mắt năm 2021, có khả năng tầm soát sớm 5 loại ung thư phổ biến nhất tại Việt Nam (vú, gan, phổi, dạ dày, đại – trực tràng) chỉ trong một lần thu máu.

Nghiên cứu cho thấy, SPOT-MAS có khả năng dự đoán vị trí khối u với độ chính xác lên đến 84%, ngay cả ở những người không có triệu chứng. Hiện tại, Gene Solutions đang tiếp tục các lượng giá lâm sàng để nâng cao độ nhạy và độ chính xác của xét nghiệm này.
Tháng 6/2024, chương trình lượng giá lâm sàng K-DETEK về SPOT-MAS với hơn 10,000 đối tượng tham dự đang chuẩn bị những công đoạn cuối cùng cho việc công bố trên tạp chí quốc tế. Nghiên cứu này hứa hẹn sẽ cung cấp những bằng chứng quan trọng mới, khẳng định các ưu thế của công nghệ SPOT-MAS về độ chính xác trong việc phát hiện sớm dấu hiệu của ung thư.
Nhìn chung, mặc dù việc tầm soát ung thư sớm thông qua phân tích ctDNA có tiềm năng ứng dụng rất lớn, phương pháp này không thể thay thế hoàn toàn các phương pháp chẩn đoán tiêu chuẩn như chụp CT scan, nội soi hay sinh thiết thường quy.
Khi bệnh nhân có kết quả xét nghiệm dương tính với ctDNA, các bác sĩ vẫn sẽ tư vấn cho bệnh nhân thực hiện các phương pháp chẩn đoán hình ảnh và sinh thiết để xác định chính xác vị trí khối u.
Xem thêm: Xét nghiệm tầm soát sớm đa ung thư SPOT-MAS
Phân tích ctDNA có thể xác định được các đột biến trong khối u. Những đột biến này đóng vai trò vô cùng quan trọng trong lâm sàng, vì mục tiêu cuối cùng là sử dụng các thông tin về các đột biến trong ctDNA để đưa ra những quyết định điều trị cụ thể. Hiện tại, có rất nhiều đột biến đích, đơn cử như đột biến trong các gen KRAS, EGFR, BRAF và PIK3CA, thường được phát hiện bằng phương pháp PCR do chi phí thấp, tốc độ nhanh và dễ thực hiện. Tuy nhiên, đặc trưng của các xét nghiệm PCR là chỉ xác định được đột biến khi đã xác định rõ về đột biến, do đó, ứng dụng của phương pháp này chỉ hạn chế về giới hạn ứng dụng cho một số loại ung thư nhất định.
So với các phương pháp dựa trên PCR, NGS (giải trình tự gen thế hệ mới) có khả năng khảo sát nhiều gen cùng lúc và phát hiện nhiều loại đột biến khác nhau. NGS không chỉ phát hiện đột biến điểm mà còn phát hiện các đột biến chèn hoặc xóa, khuếch đại, bất ổn vi vệ tinh, cũng như các hợp nhất gen và chuyển đoạn có thể là mục tiêu điều trị trong các loại ung thư khác nhau. Hiện nay, FDA đã phê duyệt hai xét nghiệm sinh thiết lỏng ctDNA dựa trên NGS, đó là Guardant360 CDx và FoundationOne CDx, có khả năng giải trình tự lần lượt 55 gen và 311 gen. Cả hai xét nghiệm này sử dụng phương pháp lai để thu giữ các đoạn cfDNA từ huyết tương trước khi phân tích giải trình tự.
Nhiều công ty khác cũng đang phát triển các xét nghiệm ctDNA dựa trên NGS. Trong đó, Gene Solutions cũng là một trong những đơn vị đang triển khai nghiên cứu và thực hiện xét nghiệm điều trị đích và theo dõi điều trị dựa trên công nghệ NGS. Với lợi ích mà phương pháp này mang lại, cũng như chi phí xét nghiệm ngày càng giảm, NGS có thể trở thành công nghệ chủ đạo cho các xét nghiệm ctDNA sinh thiết lỏng trong tương lai, mở ra nhiều cơ hội hơn cho việc phát hiện và điều trị ung thư một cách hiệu quả và chính xác.
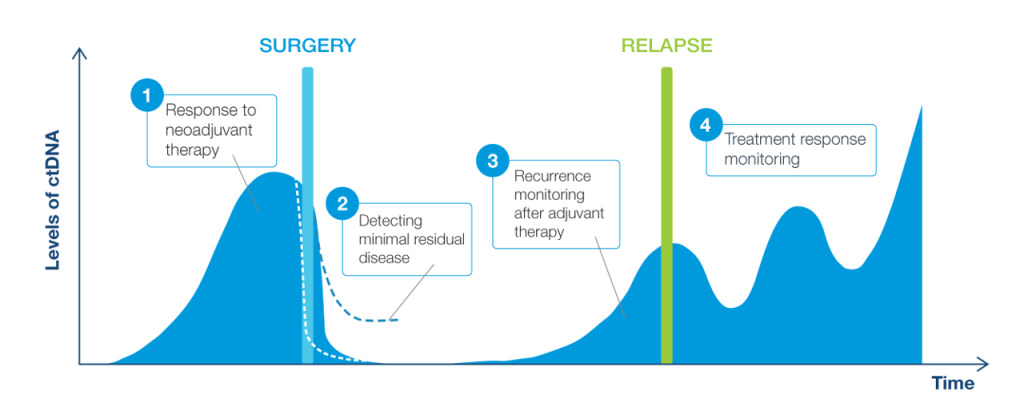
Bên cạnh hai công dụng trên, ctDNA còn được xem là một công cụ hỗ trợ tuyệt vời nhằm theo dõi trong điều trị và sau điều trị ung thư. Một trong những phương pháp được tích hợp trong điều trị phải kể đến là việc phát hiện tồn dư tối thiểu (MRD).
Để dễ hiểu hơn, quá trình điều trị ung thư phải trải qua rất nhiều bước, việc lên phác đồ điều trị cá thể hóa cho từng bệnh nhân còn tùy thuộc vào nhiều yếu tố như: giai đoạn, sức khỏe người bệnh,… Trong từng giai đoạn, bác sĩ sẽ đưa ra những phương pháp để chẩn đoán và can thiệp điều trị khác nhau. MRD (Minimal residual disease) là tồn dư tối thiểu khối u thường được ứng dụng trong giai đoạn:
Ở giai đoạn này, tình trạng bệnh nhân vẫn còn nhẹ, khối u chưa di căn sang các bộ phận khác, nên phẫu thuật là phương pháp điều trị ban đầu phổ biến. Phẫu thuật triệt căn là phương pháp điều trị chính, các phương pháp khác như hóa trị và xạ trị sẽ là những phương pháp hỗ trợ bổ trợ. Phần lớn các trường hợp ung thư ở giai đoạn này sẽ được chỉ định phẫu thuật.
Phẫu thuật triệt căn nhằm mục tiêu loại bỏ toàn bộ khối u và bất kỳ mô nào có khả năng bị ảnh hưởng bởi ung thư, bao gồm các hạch bạch huyết xung quanh và đôi khi là các cơ quan lân cận nếu cần thiết nhằm ngăn ngừa sự lây lan của ung thư.
Trong trường hợp khối u quá lớn hoặc không thể phẫu thuật, bác sĩ sẽ chỉ định cho bệnh nhân hóa trị hoặc xạ trị để thu nhỏ kích thước khối u, nhằm hỗ trợ cho quá trình phẫu thuật triệt căn trở nên thuận lợi hơn.
Tuy nhiên, điều trị ung thư không chỉ dừng lại ở phẫu thuật triệt căn. Có nhiều trường hợp phẫu thuật triệt căn không thể loại bỏ hoàn toàn tế bào ung thư. Chỉ cần còn sót lại một phần nhỏ tế bào ung thư, khối u vẫn có thể phát triển và di căn đến các bộ phận khác trong cơ thể.
Sau phẫu thuật triệt căn, MRD được sử dụng để theo dõi và đánh giá sự tồn dư tối thiểu của tế bào ung thư. MRD giúp đánh giá hiệu quả của phẫu thuật bằng cách xác định xem phẫu thuật đã loại bỏ hoàn toàn khối u hay chưa. Kết quả thông báo không phát hiện hoặc phát hiện ctDNA trong mẫu máu sau khi điều trị sẽ giúp bác sĩ đánh giá được hiệu quả của liệu pháp điều trị. Nếu không phát hiện ctDNA qua xét nghiệm MRD, bệnh nhân có thể tránh được các liệu pháp điều trị không cần thiết, giúp giảm tác dụng phụ và cải thiện chất lượng cuộc sống. Nếu MRD dương có nghĩa tế bào ung thư vẫn còn sót lại sau quá trình phẫu thuật vì vậy việc sử dụng liệu pháp điều trị hỗ trợ là điều cần thiết.
Trong trường hợp sau phẫu thuật sau phẫu thuật triệt căn và điều trị bổ trợ một thời gian, việc khảo sát MRD định kỳ, nếu có tình trạng MRD đang âm tính chuyển sang dương tính có nghĩa ung thư có nguy cơ tái phát trở lại, do đó sẽ giúp định hướng cho bác sĩ sẽ theo sát bệnh nhân hơn và chuẩn bị phương án điều trị tiếp theo.
Ở giai đoạn này, chúng ta sẽ theo dõi động năng ctDNA để đánh giá đáp ứng điều trị của bệnh nhân giúp bác sĩ có thể biết được việc điều trị có đang hiệu quả hay không từ đó bác sĩ sẽ tiếp tục phác đồ điều trị hoặc thay đổi sang một liệu pháp khác.
Cụ thể, ứng dụng động năng ctDNA giúp bác sĩ đánh giá mức độ thành công của các phương pháp điều trị. Nếu nồng độ ctDNA giảm, điều này cho thấy liệu pháp đang hoạt động hiệu quả. Ngược lại, nếu nồng độ ctDNA không thay đổi hoặc tăng lên, điều này đòi hỏi bác sĩ phải xem xét lại và điều chỉnh chiến lược điều trị để đảm bảo hiệu quả tối ưu.
Thay vì chờ đợi các triệu chứng lâm sàng xuất hiện hoặc đợi đến các lần chụp chiếu định kỳ, việc phát hiện sớm qua động năng ctDNA cho phép các bác sĩ can thiệp kịp thời, từ đó nâng cao hiệu quả điều trị và kéo dài thời gian sống của bệnh nhân. Điều này đặc biệt quan trọng đối với các loại ung thư có khả năng tái phát cao.
Các phương pháp phát hiện và phân tích ctDNA đóng vai trò quan trọng trong việc chẩn đoán, theo dõi và điều trị ung thư. Hiện nay, có hai phương pháp chính để phân tích ctDNA là phương pháp PCR điện di thời gian thực (Real-time PCR) và công nghệ giải trình tự thế hệ mới (NGS). Mỗi phương pháp đều có những ưu điểm và hạn chế riêng, giúp đáp ứng các nhu cầu khác nhau trong y học cá thể hóa.
Phương pháp PCR điện di thời gian thực (Real-time PCR) là một kỹ thuật phổ biến được sử dụng để phát hiện và phân tích ctDNA. Kỹ thuật này hoạt động bằng cách khuếch đại các đoạn DNA mục tiêu trong mẫu máu và đo lường sự khuếch đại này trong thời gian thực, cho phép phát hiện các đột biến cụ thể với độ nhạy và độ đặc hiệu cao.
Một hạn chế khác của phương pháp này là tính không đồng nhất của các khối u. Các khối u bao gồm nhiều quần thể tế bào khác nhau, mỗi quần thể có những đặc điểm di truyền và phân tử riêng. Sự không đồng nhất này có thể gây khó khăn trong việc phân tích dấu ấn sinh học, vì một dấu ấn sinh học đơn lẻ có thể không phản ánh được toàn bộ sự phức tạp của khối u.
Công nghệ giải trình tự thế hệ mới (Next-Generation Sequencing – NGS) hiện tại đang là một bước đột phá được đánh giá cao trong việc phát hiện và phân tích ctDNA.
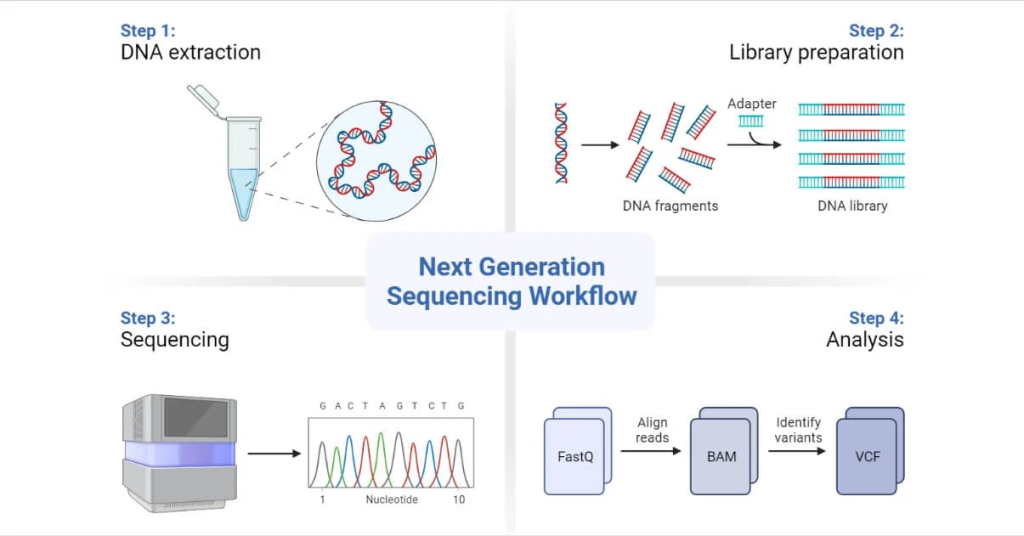
Nguyên lý hoạt động của NGS cho phép giải trình tự toàn bộ bộ gen hoặc các đoạn gen mục tiêu từ mẫu ctDNA, giúp xác định tất cả các đột biến có mặt trong mẫu.
Cả Real-time PCR và NGS đều có những ưu điểm và hạn chế riêng, và sự lựa chọn giữa hai phương pháp này phụ thuộc vào mục tiêu cụ thể của nghiên cứu hoặc điều trị.
Việc lựa chọn phương pháp phân tích ctDNA còn phù hợp phụ thuộc vào mục tiêu của nghiên cứu và điều trị. Nhìn chung, Real-time PCR là lựa chọn tối ưu cho việc phát hiện nhanh và chi phí thấp các đột biến đã biết trước, trong khi NGS cung cấp cái nhìn toàn diện và chi tiết, phù hợp cho việc nghiên cứu toàn bộ bộ gen và khám phá các đột biến mới. Sự kết hợp giữa các phương pháp này có thể mang lại hiệu quả cao nhất trong việc phát hiện và điều trị ung thư cá thể hóa.
Hiện tại, Gene Solutions đang dẫn đầu tại Việt Nam trong việc tiên phong nghiên cứu và ứng dụng phân tích ctDNA trong các xét nghiệm liên quan đến ung thư. Phương pháp tiên tiến này được tích hợp vào tất cả các giai đoạn từ tầm soát sớm đến điều trị và theo dõi sau điều trị. Một số xét nghiệm nổi bật sử dụng phân tích ctDNA trong điều trị và theo dõi tái phát sau ung thư bao gồm:
oncoGS là xét nghiệm ứng dụng công nghệ NGS để khảo sát hầu hết các đột biến đích được các bác sĩ Ung thư ứng dụng rộng rãi vào điều trị. Các đột biến đích tìm thấy trong xét nghiệm này có các liệu pháp điều trị nhắm trúng đích liên quan được NCCN và Cục quản lý thực phẩm và Dược phẩm Hoa Kỳ (FDA) khuyến cáo.
oncoGS được ứng dụng phân tích ctDNA để xác định các đột biến trong khối u của từng bệnh nhân. oncoGS được áp dụng cho 12 loại ung thư khác nhau, bao gồm: ung thư phổi, đại – trực tràng, vú, tụy, tuyến tiền liệt, cổ tử cung, buồng trứng, tuyến giáp, dạ dày, u mô đệm đường tiêu hóa, hắc tố da, mô bào.

Xét nghiệm này sử dụng công nghệ giải trình tự gen hiện đại để phân tích ctDNA từ mẫu máu của bệnh nhân, giúp phát hiện các đột biến đích, đột biến kháng thuốc cho từng loại ung thư, từ đó lựa chọn các liệu pháp điều trị nhắm trúng đích. Ví dụ, trong ung thư phổi, oncoGS có thể phát hiện các đột biến PIK3CA, EGFR, TP53, KRAS, SKT11, BRAF, KEAP1, NRAS, ROS1 fusion, NTRK fusion, MET amplification/mutations, HER2 amplification/mutations, ALK fusion/mutations, RET fusion/mutations, từ đó bác sĩ có thể chọn các các thuốc điều trị nhắm trúng đích tương ứng.
oncoGS không chỉ tập trung vào một gen đột biến cụ thể mà cung cấp thông tin phân tích đa gen cho mỗi loại ung thư. Những thông tin này giúp bác sĩ có cái nhìn toàn diện để đưa ra quyết định điều trị chính xác. Đồng thời, việc trả kết quả phân tích nhanh chóng sẽ hỗ trợ bác sĩ đưa ra các quyết định điều trị kịp thời.
K-Track là một trong những xét nghiệm tiên tiến được nghiên cứu và phát triển bởi Viện Di truyền Y học Gene Solutions. K-TRACK™ mang đến giải pháp giải trình tự gen thế hệ mới (NGS) tối ưu và tiết kiệm hơn, bằng cách phân tích 4 chỉ dấu phân tử khối u quan trọng nhất của từng bệnh nhân: Phát hiện tồn dư tối thiểu khối u (MRD) và theo dõi tái phát sớm thông qua ctDNA trong máu, xác định các đột biến đích hỗ trợ liệu pháp điều trị nhắm trúng đích, phát hiện đột biến di truyền (germline mutation) và bất ổn định vi vệ tinh (MSI).
Ngoài khả năng phát hiện tồn dư tối thiểu khối u (MRD), panel gen và hotspot mở rộng của K-TRACK MET, K-TRACK BO còn cho phép theo dõi động năng ctDNA ở bệnh nhân giai đoạn tiến xa – di căn hoặc bệnh nhân không có mẫu mô, cung cấp giải pháp theo dõi ctDNA – ứng dụng lâm sàng trong việc dự đoán khả năng sống còn không bệnh và phát hiện sớm tái phát.

Kết quả K-TRACK phát hiện tồn dư tối thiểu khối u (MRD)/theo dõi động năng ctDNA sẽ có 2 dạng: DƯƠNG TÍNH hoặc ÂM TÍNH với sự hiện diện của ctDNA trong máu. Cụ thể:
K-4Care là một giải pháp tiên tiến, có khả năng khảo sát 473 gene cho tất cả các loại ung thư mô đặc trong một xét nghiệm duy nhất. Giải pháp này tích hợp nhiều chỉ dấu phân tử để dự đoán khả năng đáp ứng với các phương pháp điều trị, từ đó mở rộng các lựa chọn điều trị như liệu pháp điều trị đích. K-4Care dành cho bệnh nhân ung thư ở giai đoạn sớm và tiến xa – di căn.
K-4Care được thiết kế để tối ưu hóa việc theo dõi đáp ứng điều trị và hỗ trợ phát hiện sớm tái phát ung thư thông qua tích hợp phân tích ctDNA. Công nghệ này cung cấp thông tin chi tiết về sự thay đổi của khối u trong quá trình điều trị.

Mặc dù phân tích ctDNA hứa hẹn mang lại nhiều tiềm năng phát triển trong tương lai gần, nhưng lĩnh vực này vẫn phải đối mặt với không ít thách thức.
Việc lấy mẫu và bảo quản ctDNA đòi hỏi kỹ thuật cao và quy trình nghiêm ngặt để đảm bảo tính toàn vẹn của mẫu. Các yếu tố như nhiệt độ, thời gian bảo quản, và điều kiện vận chuyển có thể ảnh hưởng đáng kể đến chất lượng và độ tin cậy của kết quả phân tích. Do đó, chuẩn hóa các quy trình lấy mẫu và bảo quản là điều cần thiết để đảm bảo tính nhất quán, tái lập của các nghiên cứu.
Một thách thức lớn trong việc sử dụng ctDNA là xác định nguồn gốc của các tín hiệu ctDNA. Do ctDNA có thể xuất phát từ nhiều nguồn khác nhau trong cơ thể, việc phân biệt giữa ctDNA từ các khối u và các nguồn không phải khối u là rất khó khăn. Điều này đòi hỏi sự phát triển của các phương pháp phân tích phức tạp và chính xác để có thể xác định đúng vị trí của khối u trong cơ thể.
Đề vượt qua rào cản này và đưa công nghệ phân tích ctDNA vào trong thực tiễn, các công ty cần xây dựng các mô hình máy học và áp dụng trí tuệ nhân tạo trong phân tích các tín hiệu ctDNA. Điều này đòi hỏi các công ty cần làm chủ công nghệ thuật toán cũng như xây dựng và không ngừng mở rộng cơ sở dữ liệu sinh học khối u nhằm nâng cao độ chính xác trong việc dự báo nguồn gốc của tín hiệu ctDNA.
Xét nghiệm SPOT-MAS do viện di truyền Y học phát triển là một thành công hiếm hoi trong lĩnh vực này khi đạt độ chính xác trong dự báo vị trí khối u lên đến 84%.
Bittla, P., Kaur, S., Sojitra, V., Zahra, A., Hutchinson, J., Folawemi, O. and Khan, S. (2023) “Exploring Circulating Tumor DNA (CtDNA) and Its Role in Early Detection of Cancer: A Systematic Review,” Curēus (Palo Alto, CA), 15(9), pp. e45784–e45784. Available at: https://doi.org/10.7759/cureus.45784.
Roy, D., Lucci, A., Ignatiadis, M. and Jeffrey, S.S. (2021) “Cell-free circulating tumor DNA profiling in cancer management,” Trends in molecular medicine, 27(10), pp. 1014–1015. Available at: https://doi.org/10.1016/j.molmed.2021.07.001.
Hiện nay, ứng dụng ctDNA chủ yếu tập trung vào các loại ung thư phổ biến như ung thư phổi, ung thư vú và ung thư đại trực tràng. Việc mở rộng ứng dụng ctDNA cho các loại ung thư hiếm vẫn gặp nhiều thách thức do thiếu dữ liệu và mẫu thử nghiệm. Để tận dụng hết tiềm năng của ctDNA trong y học, cần có thêm nghiên cứu về các loại ung thư hiếm và phát triển các phương pháp đặc hiệu cho từng loại ung thư này.
Công nghệ phân tích ctDNA đang phát triển nhanh chóng với nhiều cải tiến trong kỹ thuật phân tích và ứng dụng lâm sàng. Với tiềm năng này, phân tích ctDNA có thể phát triển theo các hướng sau:
Những tiến bộ này sẽ góp phần nâng cao khả năng chẩn đoán và điều trị ung thư, mở ra nhiều triển vọng mới cho ứng dụng ctDNA trong y học hiện đại.
Tham khảo:
https://www.worldscientific.com/doi/full/10.1142/S2339547818300020
https://www.statcan.gc.ca/o1/en/plus/317-cancer-six-letter-word-everyone-dreads-hear
https://www.eurekalert.org/multimedia/925082
Cố vấn chuyên môn: Bác sĩ Nguyễn Thị Thanh – Viện Di truyền Y học Gene Solutions
Phân tích ctDNA đã mở ra một kỷ nguyên mới trong y học cá thể hóa, mang lại hy vọng lớn cho việc chẩn đoán và điều trị ung thư. Dù đối mặt với nhiều thách thức, những tiến bộ trong công nghệ và phương pháp phân tích đã và đang tạo điều kiện thuận lợi cho việc ứng dụng ctDNA trong lâm sàng. Đặc biệt, khả năng phát hiện sớm, theo dõi tiến triển bệnh và cá thể hóa điều trị đã giúp nâng cao hiệu quả điều trị và cải thiện chất lượng cuộc sống của bệnh nhân ung thư.
Để phát huy hết tiềm năng của ctDNA, cần có sự hợp tác chặt chẽ giữa các nhà khoa học, bác sĩ và cơ quan quản lý nhằm chuẩn hóa quy trình và phát triển các kỹ thuật mới. Đồng thời, mở rộng nghiên cứu ứng dụng ctDNA cho các loại ung thư hiếm và các bệnh lý khác sẽ giúp tận dụng tối đa những lợi ích mà công nghệ phân tích này mang lại. Với sự nỗ lực không ngừng, ctDNA hứa hẹn sẽ trở thành một công cụ quan trọng trong cuộc chiến chống ung thư, góp phần nâng cao khả năng chẩn đoán và điều trị, mở ra nhiều triển vọng mới cho y học hiện đại nói chung và y học cá thể hóa nói riêng.

Chương trình dành cho cộng đồng “Vì một Việt Nam không còn nỗi lo ung thư”, nhằm góp phần nâng cao nhận thức về tầm soát, phát hiện sớm ung thư thông qua hình thức tặng 7.000 suất tầm soát ung thư miễn phí bằng công nghệ SPOT-MASTM, cho hơn 100 doanh nghiệp, bệnh viện và phòng khám khắp cả nước.
» Xem chi tiết «
» Xem trên VNExpress «
© 2020 BẢN QUYỀN THUỘC VỀ GENE SOLUTIONS
Người đại diện Pháp luật: Nguyễn Hữu Nguyên
GPĐKKD số 0314215140 – sở KHĐT TP. HCM cấp ngày 23/01/2017
Tư vấn di truyền